- •VI семестр лекция 1 Коагуляция и флокуляция
- •3. Доза коагулянта.
- •4. Флокулянты
- •Мицелла (коллоидная частица)
- •Лекция 2 Электрохимическое коагулирование
- •Лекция 3 Отстаивание
- •Лекция 4 Фильтрование
- •Лекция 5 Стабилизация воды систем водоснабжения
- •Лекция 6 железо в природных водах
- •Лекция 7 деманганация воды
- •VII семестр Лекция 8 Мембранная сепарация
- •Лекция 9 электродиализ
- •Лекция 10 Нейтрализация
- •Лекция 11 дистилляция. Эвапорация. Дегазация
- •Лекция 12 обеззараживание воды
- •Лекция 13 Ионный обмен
- •Лекция 14 экстракция
- •Дополнительные лекции
- •Лекция 1
- •Баромембранные явления, закономерности. Классификация мембран по размерам пор. Предварительная подготовка воды
- •Классификация мембран по размерам пор
- •Предварительная подготовка воды
- •Лекция 2
- •Лекция 3
Мицелла (коллоидная частица)
Лекция 2 Электрохимическое коагулирование
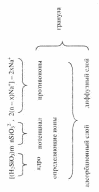
Ионы алюминия и железа, необходимые для коагулирования содержащихся в воде частиц коллоидных загрязнений могут быть получены электрохимическим анодным растворением металлического алюминия и железа. Для этого воду нужно пропустить через электролизер с анодами из алюминия или железа.
Металл пластин анодов, подключенных к «+» полюсу тока, будет при этом ионизироваться и переходить в раствор в виде ионов (Fe2+, Al3+).
При расчете установок для очистки воды с электролитическим растворением металлов следует иметь в виду, что растворение в воде 1 г металлического алюминия эквивалентно введению в воде 6,35 г сульфата алюминия; растворение 1 г металлического железа – обработке воды 1,93 г хлорного железа.
Коллоидные и взвешенные частицы в связи с малой подвижностью переносят незначительную часть тока. Основной перенос электричества осуществляют ионы: Na+, K+, Ca2+, Mg2+, HCO3‑, SO42‑, Cl‑, H+ или OH‑.
Электрохимическое растворение металла включает в себя следующие группы процессов:
I Растворение за счет внешнего тока (анодное растворение металла)
Общая реакция с образованием гидратированных ионов:
[M]0 + x H2O Mz+xH2O + ze
Al0 + 6 H2O Al3+6H2O + 3e
Количество металла (m), растворенного в воде в результате электролиза, определяется по формуле:
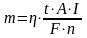 ,
в граммах
,
в граммах
‑ выход металла по току, %;
t – время прохождения тока;
A – атомный вес металла
I – сила тока, А;
F= NАe=96,490103 Кл/моль – постоянная Фарадея;
n – валентность металла анода (для алюминия =3)
II Химическое растворение (в результате взаимодействия с окружающей средой)
На аноде:
анодное растворение:
Al0 ‑ 3e Al3+ (если анод алюминиевый)
Fe0 ‑ 2e Fe2+ (если анод железный)
образование гидроокисей:
Al3+ + 3OH‑ Al(OH)3
НА КАТОДЕ при погружении в природную воду:
деполяризация мигрирующими ионами:
2H+ + 2e H2;
Fe3+ + e Fe2+;
деполяризация нейтральными молекулами:
O2 + 4e + 2H2O 4OH‑; (в щелочной среде)
O2+ 4e + 4H+ 2H2O; (в кислой среде)
или
Cl2 + 2e 2Cl‑;
восстановление ионов металлов и нерастворимых пленок, например, пленок окислов:
Fe2+ + 2e Fe0;
Fe3O4 + H2O + 2e 3FeO + 2OH‑;
4) восстановление органических соединений (R – органический радикал):
RO + 4e + 4H+ RH2 + H2O;
R + 2e + 2H+ RH2
В зависимости от условий превалируют процессы 1) и 2).
5) Из-за процесса деполяризации мигрирующими протонами уменьшается содержание протонов в растворе, рН увеличивается. У катода скапливаются ОН‑. При рН 10,5…12 на алюминиевом катоде возможно:
2Al0 + 6H2O – 6e 2 Al(OH)3 + 3H2;
Электролиз сопровождается следующими процессами:
Адсорбцией на электродах неорганических и органических соединений, которые могут ускорять/ замедлять скорость электрохимических реакций.
Электрофлотацией. Пузырьки Н2 и О2, выделяющиеся при электролизе, способны переносить вещество из жидкости на поверхность.
На процесс электролиза влияют:
Состав электродов.
‑ введение в алюминий легирующих элементов (медь, марганец) увеличивает скорость растворение анода.
‑ введение магния уменьшает скорость растворения алюминия в щелочной среде из-за образования окисной пленки Mg(OH)2.
Плотность тока: экономически выгодна высокая плотность тока, но с ее ростом увеличивается скорость поляризации и пассивация электродов, что приводит к потерям электроэнергии.
Скорость движения воды
При увеличении скорости движения воды предотвращается образование окисной пленки и уменьшается поляризация, однако, увеличивается количество растворенного алюминия.
Температура.
При увеличении температуры уменьшается образование осадков на электродах, но скорость растворения пассивирующей пленки увеличивается.
Присутствие анионов.
Cl‑ активирует алюминиевый анод, т.к. легко проникает через пассивирующую пленку, разрушает ее.
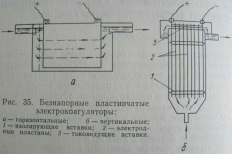
Конструкции электрокоагуляторов
Безнапорные пластичные электролизеры горизонтального или вертикального типов. Пластины металлов располагаются на расстоянии 3…20 мм одна от другой и удерживаются изолирующими вставками. Электрический ток подводится к каждой пластине.
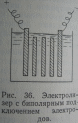
Биполярное подключение электродов в электролизере (рис.). Упрощается монтаж, уменьшается потребление тока. Подвод тока осуществляется не к каждой пластине, а через несколько. Промежуточные платины также растворяются вследствие поляризации в возникающем электрическом поле.
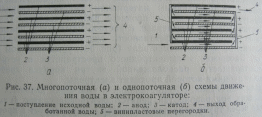
В зависимости от расположения электродов и направляющих перегородок, электролизеры бывают (рис. ):
а) многопоточные. Вода одновременно проходит через все промежутки между электродами. Монтаж прост, но скорость движения воды мала, пассивация увеличивается.
б) однопоточные. Вода проходит по лабиринту, образованному электродами. При этом:
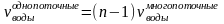 ,
,
где n – число электродных пластин.
|
|
|
|
Применение электрокоагуляции
Осветление и обесцвечивание воды. Электрокоагуляция расширяет оптимальную зону коагуляции, ускоряет хлопьеобразование и осаждение.
Удаление сине-зеленых водорослей, особенно с использованием железных электродов.
а) Обезжелезивание; б) Обескремнивание; в) Обескислороживание. Используют для уменьшения коррозионной активности воды по отношению к железу:
В электролизере с железными электродами катодный процесс кислородной деполяризации дополняется химическим процессом образования гидроксида железа (II) и окисления его до гидроксида железа (III):
Fe2+ + 2OH‑ Fe(OH)2
Fe(OH)2 + O2 + 2H2O 4 Fe(OH)3
Наличие в рабочем пространстве электролизера пиролюзита или активированного угля приводит к окислению водорода, выделяющегося на катоде:
4H2 + O2 2H2O
Очистка сточных вод (используют стальные (т.е. железные) аноды) от жиров, масел, нефтепродуктов, хрома, сульфитов, СПАВ и др. При электролизе в воду переходят ионы железа (II), образуется гидроксид железа (II), который в присутствии кислорода окисляется до гидроксида железа (III). Хлопья гидроксидов железа сорбируют на своей поверхности загрязнения и удаляются из воды отстаиванием или фильтрованием.