- •VI семестр лекция 1 Коагуляция и флокуляция
- •3. Доза коагулянта.
- •4. Флокулянты
- •Мицелла (коллоидная частица)
- •Лекция 2 Электрохимическое коагулирование
- •Лекция 3 Отстаивание
- •Лекция 4 Фильтрование
- •Лекция 5 Стабилизация воды систем водоснабжения
- •Лекция 6 железо в природных водах
- •Лекция 7 деманганация воды
- •VII семестр Лекция 8 Мембранная сепарация
- •Лекция 9 электродиализ
- •Лекция 10 Нейтрализация
- •Лекция 11 дистилляция. Эвапорация. Дегазация
- •Лекция 12 обеззараживание воды
- •Лекция 13 Ионный обмен
- •Лекция 14 экстракция
- •Дополнительные лекции
- •Лекция 1
- •Баромембранные явления, закономерности. Классификация мембран по размерам пор. Предварительная подготовка воды
- •Классификация мембран по размерам пор
- •Предварительная подготовка воды
- •Лекция 2
- •Лекция 3
Лекция 12 обеззараживание воды
Все наблюдаемые поверхностные водоисточники и системы водоснабжения, расположенные в различных климатических зонах страны (Сев.-западный регион, Центральный район России, Дальний Восток), в той или иной степени содержат цисты лямблий и др. патогенных простейших. 1993 г. – 30,5% проб воды централизованного хоз-питьевого водоснабжения России не отвечали гигиеническим требованиям по санитарно-химическим показателям. В России ежегодно фиксируется все большее количество вспышек острых кишечных заболеваний, обусловленных водным фактором передачи инфекции (дизентерия, острые кишечные инфекции, вирусный гепатит и др.). В бассейнах рек Обь, Печора, Урал и др. зачастую содержание пестицидов превышало ПДК на 20 % (Вода питьевая: Гос. Доклад // Зеленый мир. – 1995. – №18-20.) Экономический ущерб от загрязнения водных источников (по данным доклада) проявляется в сфере материальнонго производства, здравоохранения, социального обеспечения, рекреации. Только в 1993 году дополнительные затраты на водоподготовку не загрязненных водоемах составили (по неполным данным) около 250–300 млрд. руб. Обостряющаяся водохозяйственным обстановка в России в результате сброса загрязняющих веществ в водные объекты и плохого технического состояния водохозяйственных фондов наносила ежегодно ущерб в размере 535 трл. руб. (без учета атмосферного загрязнения с водосборной площади). Здоровью населения за счет неудовлетворительного состояния рекреационных водных объектов наносится ущерб ежегодно в среднем на 9 млрд. руб. [Авакумов Г.А., Выборнова М.С. Состояние водоисточников и качество питьевой воды / Водоснабжение и сантехника. – 1991. – №2. – С. 22–25.]
Одной из основных задач очистных сооружений водопровода и канализации является предотвращение возможного распространения через воду кишечных инфекций. Эффективность работы станций полной биологической очистки сточных вод по удалению бактериальных загрязнений обычно составляет 90—95%. Коагулирование, отстаивание и фильтрование воды на водопроводных станциях также обеспечивают изъятие основной части микрофлоры и микрофауны природной воды. Однако санитарно-эпидемиологическая безопасность воды обеспечивается только при условии ее обеззараживания. Обработка дезинфецирующими агентами обеззараживает воду, а также улучшает качество воды за счет окислительного разрушения и связывания некоторых примесей воды.
Обеззараживание (дезинфекция) воды – удаление из нее и уничтожение патогенных микроорганизмов.
Методы обеззараживания воды:
Реагентные: с помощью окислителей (хлор, диоксид хлора, гипохлорит натрия и кальция, хлорная известь, хлорамины, озон, пероксид водорода, перманганат калия и др.)
Безреагентные: термический, ультразвуковой, УФ-облучения, радиоактивного облучения.
Действие обеззараживающих агентов
Бактериальная клетка (размеры 0,5–5 мкм, средняя масса 410–12 г) достаточно прочно защищена от воздействия внешних факторов прочной и устойчивой оболочкой (толщина 10–40 нм), которая, разбухая, образует наружный гелеобразный слизистый слой (капсулу). В состав оболочки входят белки, мукополисахариды, мукопротеины, липоиды сахара. Под оболочкой клетки находится цитоплазматическая мембрана (толщина 5–10 нм), назначение которой – барьерная функция, концентрирование внутри клетки питательных веществ и выделение наружу продуктов обмена.
В цитоплазматическую мембрану заключена цитоплазма – комплекс коллоидных веществ и органоидов клетки с вязкостью в 103–104 раз больше вязкости воды. В цитоплазме каждой клетки насчитывается до 104 рибосом, состоящих из белка, фосфолипидов и РНК. В большинстве клеток вместо ядра находится ядерная вакуоль (нуклеотид), внутри которой – сгусток нитей ДНК.
Т.О., точки зрения обеспечения жизнедеятельности клетки основными органоидами, поражение которых приводит к инактивации клетки, являются ДНК нуклеотида, рибосомы, цитоплазматическая мембрана. Последняя наиболее уязвима по жизненной важности, по наличию функциональных групп, по доступности для транспорта дезинфектанта.
Химическое взаимодействие дезинфектанта происходит по функциональным группам мишени (органоида). Наиболее реакционноспособными группами являются сульфгидрильные группы (–SH), входящие в белки цитоплазматической мембраны.
Для полной инактивации клетки необходимо проникновение дезинфицирующего агента внутрь клетки и взаимодействие с ДНК нуклеотида. Микроорганизмы характеризуются различной устойчивостью к действию хлора и хлорсодержащих агентов. Наиболее устойчивы к действию хлора фекальные колиформы, поэтому штамм E-coli используют в качестве санитарно-показательного микроорганизма при оценке надежности обеззараживания. Хлор мало активен в отношении споровых микроорганизмов. Эффективно обеззараживание по отношению к гельминтам и водорослям, возбудителям туляремии, брюшного тифа, дизентерии и др.
Любой вид обеззараживания приводит к поражению и гибели бактериальной клетки в результате свертывания белков цитоплазмы, или нарушения пограничных структур клетки, или химического взаимодействия обеззараживающего агента с клеточными веществами. Бактерицидные агенты могут обладать и комбинированным действием, под которым подразумевается одновременное проявление нескольких механизмов поражения клетки.
При тепловой обработке и при действии электролитов происходит свертывание белков, коагуляция коллоидов цитоплазмы. Соли серебра и меди вызывают повреждение белковых структур, и в частности ферментов. Особенностью этих соединений является их способность оказывать микробоцидное действие в очень малых концентрациях (олигодинамическое действие).
СПАВ, некоторые антибиотики, фенолы, спирты воздействуют на поверхностные структуры клетки. Например, СПАВ, сорбируясь на поверхности клетки, нарушают проницаемость оболочки и цитоплазматической мембраны, что приводит к нарушению равновесия клетки с окружающей средой и к ее гибели. Ультразвук приводит к механическому нарушению целостности клеточной стенки и мембраны.
Ионизирующее излучение, способное вызывать ионизацию атомов и молекул, разрушает молекулярные структура цитоплазмы.
Микробоцидное действие сильных окислителей объясняется их способностью вступать в химическое взаимодействие с компонентами цитоплазматической мембраны и разнообразными биополимерами цитоплазмы клетки.
Для обеззараживания питьевых и сточных вод чаще всего применяют обработку воды сильными окислителями. В качестве окислителей используют хлор и его соединения (хлорная известь, диоксид хлора), а также озон. Для обеззараживания подземных вод применяют и бактерицидное облучение.
Эффективность снижения бактериальных загрязнений сточных вод на станциях полной биологической очистки с обеззараживанием повышается до 99,5—99,99%. Коли-нндекс биологически очищенных сточных вод, сбрасываемых в водоем, не должен при этом быть выше 1000. Обеззараживание воды на коммунальных водопроводах обеспечивает практически полное уничтожение коли-форм (коли-индекс не более 3).
Сильные окислители, однако, не оказывают губительного действия на яйца гельминтов. В процессе биологической очистки сточных вод частичное освобождение воды от сапрофитной и патогенной микрофлоры и яиц гельминтов достигается уже на первых стадиях ее обработки. В результате первичного отстаивания концентрация бактерий и яиц гельминтов в воде снижается примерно на 50% за счет сорбции их оседающими взвешенными частицами. В избыточном активном иле оказывается еще около 40% яиц гельминтов. Поскольку суммарный объем осадка из первичных отстойников и избыточного активного ила не превышает 1—1,5% объема очищаемой воды, понятно, что в санитарном отношении осадки представляют еще большую опасность, чем сточная вода.
Обеззараживание осадков природных и сточных вод. Обезвреживание и полная дегельминтизация осадков сточных вод достигаются в результате анаэробного сбраживания их в термофильных условиях (t =50—55 °С). В мезофильном режиме при температуре 30—33 °С погибает около половины яиц гельминтов. При отсутствии на станциях метантенков обеззараживание осадка осуществляют с помощью газовых горелок инфракрасного излучения, прогревом осадка острым паром до t = 60-65°С, известкованием или компостированием. Перечисленные методы применимы для обработки небольших количеств осадков.
Хлорирование
Хлорирование является наиболее распространенным, а иногда и единственным процессом, используемым для очистки (обеззараживания) воды.
Реагенты для хлорирования [3]:
Реагент |
Формула |
Принято называть |
Бактерицидное действие |
хлор газообразный |
Cl2 |
«свободный хлор» |
25x |
гипохлорит кальция или натрия |
Ca(ClO)2 или NaClO |
||
хлорная известь |
Ca(ClO)22Ca(OH)22H2O дветретиосновная кальциевая соль гипохлоритной кислоты* |
||
оксид хлора (IV) |
ClO2 |
||
Хлорамины** |
NHCl2 дихлорамин |
«связанный хлор» |
x |
NН2Сl монохлорамин |
(1/3…1/5)x |
*) Получают хлорированием известкового молока.
**) Хлорпроизводные органических аминов и иминов имеют бактерицидное действие в 8–10 раз ниже, чем хлорамины.
Все реагенты содержат активный хлор – хлор, входящий в состав хлорсодержащих препаратов и способный при определенном значении pH выделять эквивалентные количества иода из водных растворов иодида калия.
Хлор при введении в воду гидролизуется с образованием хлорноватистой и соляной кислот:
Cl2 + H2O HOCl + HCl
Хлорноватистая кислота диссоциирует на ионы
НОСl Н+ + ОСl‑
При растворении в воде гипохлорит кальция (натрия) и хлорная известь При растворении в воде происходит гидролиз этих соединений с образованием хлорноватистой кислоты:
NaOCl + Н2О = НОСl+ NaOH,
Ca(OCl)2 + H2O = CaCl2 + Ca(OH)2 + 2HClO.
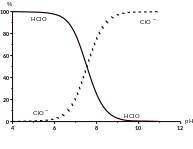
Равновесие между Сl2, НОСl и ОСl‑ зависит от рН среды (см. рис.). Бактерицидным действием обладает недиссоциированная хлорноватистая кислота, поэтому обеззараживание хлором эффективней в кислой среде при рН = 4‑7, когда в воде присутствуют в основном молекулы НОСl. Свободный активный хлор – это хлор, находящийся в растворе в виде хлорноватистой кислоты и гипохлорит-аниона. Хлорноватистая кислота более эффективна, чем ион гипохлорита, поэтому активность свободного остаточного хлора уменьшается с увеличением рН.
|
Рис. . Содержание различных форм хлорноватистой кислоты в зависимости от рН |
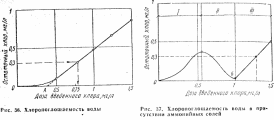
В процессе обеззараживания хлор расходуется на окисление органических примесей, содержащихся в воде, поэтому для обеспечения надежного бактерицидного эффекта в обработанной воде поддерживают определенную концентрацию остаточного хлора. Зависимость между дозой введенного и концентрацией остаточного активного хлора выражается кривой хлоропоглощаемости (рис. 36). Отрезок ОА соответствует полной хлоропоглощаемости воды. Чем больше в воде веществ, способных окисляться хлором, тем больше величина хлоропоглощаемости. Поэтому для обеззараживания сточных вод требуются большие дозы хлора. В качестве данных для предварительных расчетов следует использовать следующие дозы: для обеззараживания воды из подземных источников доза активного хлора по СНиП 2.04.02–84* должна составлять 0,7—1 мг/л, поверхностных источников после фильтрования – 2–3 мг/л, сточной воды после полной биологической очистки – 3 мг/л, а сточной воды, прошедшей только механическую очистку – 10 мг/л.
При эксплуатации очистных сооружений требуемую дозу хлора уточняют экспериментально пробным хлорированием, по результатам которого строят кривую хлоропоглощаемости воды (см. рис. 37). Задаваясь концентрацией остаточного свободного хлора, определяют необходимую дозу хлора.
Концентрации остаточного свободного и связанного хлора надлежит принимать в соответствии с ГОСТ 2874–82. При хлорировании питьевой воды концентрация остаточного свободного хлора должна быть не менее 0,3 и не более 0,5 мг/л. Количество остаточного хлора в сточной воде после 30 -мин контакта должно быть не менее 1,5 мг/л.
Хлорирование воды при наличии в ней аммиака или солей аммония требует большего расхода хлора, так как он связывается с указанными соединениями, образуя хлорамины (реакции обратимы):
NН3 + НОСl NН2Сl + Н2О;
NН2Сl+ НОСl NHCl2 + Н2O;
Этому процессу соответствует участок I (рис. 37).
Дихлорамин и монохлорамин также обладают бактерицидным действием, т.к. при гидролизе выделяют активный хлор. С повышением дозы вводимого хлора в воде постепенно возрастает концентрация остаточного хлора, связанного в хлорамины. Хлорамины обладают более слабым микробоцидным действием, чем хлор, поэтому для обеспечения требуемого эффекта обеззараживания концентрация остаточного связанного хлора в воде должна быть 0,8 — 1,2мг/л.
Если продолжать вводить хлор в воду после связывания всех аммонийных соединений в хлорамины, то начинается окисление их свободной хлорноватистой кислотой:
NH2Cl+ NHCl2+ НОСl N2O + 4НСl
NHCl2 + Н2О NH(ОН)Cl + HCl
NH(ОН)Сl+ 2НОСl HNO3 + 3HCl.
С начала протекания реакций окисления хлораминов количество остаточного связанного хлора в воде уменьшается, несмотря на увеличение дозы введенного хлора (участок II). После окончания реакций окисления хлораминов в воде появляется остаточный свободный хлор, и его количество становится пропорциональным дозе введенного хлора (участок III). Поэтому при хлорировании воды, содержащей аммонийные соединения, требуемая доза хлора определяется по прямой за точкой Б, которая называется точкой перелома.
При хлорировании воды, содержащей фенолы, в ней могут появиться неприятные запахи, обусловленные образованием хлорфенольных соединений (фенолы легко хлорируются, при этом ОН-группа, как заместитель первого рода, направляет заместитель в орто- и пара- положения). Для предотвращения образования запахов проводят хлорирование с аммонизацией. В воду сначала вводят аммиак, а затем хлор. Образующиеся хлорамины препятствуют взаимодействию фенолов с хлором, что предотвращает образование хлорфенольных запахов.
На эффективность обеззараживания воды хлором влияют:
Минеральные и органические примеси воды – их большое количество снижает действие хлора (прежде всего за счет уменьшения его концентрации). Бактерии, попадающие внутрь взвешенных частиц, механически экранируются от действия окислителей
Некоторые органические примеси могут стимулировать размножение микроорганизмов.
В последние годы разработан и находит применение электрохимический метод обеззараживания воды. Электролизу подвергают морскую, соленую подземную воду или раствор поваренной соли. В процессе электролиза протекают следующие реакции:
на аноде(+):
1) 2Сl‑ – 2е- Сl2;
2) 2H2O – 4е- O2 + 4H+;
на катоде (+)
3) 2 Н2О + 2 е- Н2 + 2ОH‑.
Выделяющийся на аноде хлор гидролизуется с образованием хлорноватистой кислоты:
Cl2 + H2O HOCl + HCl
Ионы гидроксила связываются с ионами натрия:
ОН‑ + Na+ NaOH.
В результате взаимодействия хлорноватистой кислоты и щелочи образуется гипохлорит натрия:
НОСl + NaOH NaOCl + Н2O.
Электролиз морской воды позволяет получить продукт с концентрацией активного хлора до 3 г/л. Более высокие концентрации (до 8 мг/л) могут быть получены при электролизе растворов поваренной соли.
Обеззараживание воды прямым электролизом возможно при содержании хлоридов не менее 20 мг/л и жесткости не более 7 мг-экв/л на станциях с производительностью до 5 тыс. м3/сут.
Химизм процессов, протекающих при добавлении продуктов электролиза к обеззараживаемой воде, не отличается от общих закономерностей хлорирования. Применение электрохимического метода обеззараживания позволяет избежать трудностей, связанных с транспортированием и хранением токсичного газообразного хлора.
В схемах водоподготовки различают пре- и постхлорирование.
Прехлорирование проводится перед другими методами обработки воды при значительных заражениях воды и большими дозами хлора. При этом не требуется последующего дехлорирования, т.к. избыточное количество хлора удаляется при последующей обработке воды.
Постхлорирование бывает:
1) Нормальное хлорирование. Применяют при небольшом загрязнении воды. Дозу хлора устанавливают такую, чтобы для сохранения бактерицидных свойств в течение длительного времени концентрация остаточного хлора в воде после 30 минутного контакта воды с хлором была не менее 0,3 мг/л.
2) Суперхлорирование. Применяют при эпизодическом бактериальном загрязнении воды стойкими культурами, когда нормальное хлорирование не дает нужного эффекта. Доза остаточного хлора при этом допускается в пределах 1,0 –10,0 мг/л. Избыток остаточного хлора удаляют дехлорированием: большое количество – добавками восстанавливающего агента – дехлора (тиосульфата или сульфита натрия, дисульфита натрия, аммиака, сернистого ангидрида, активированного угля), небольшое количество – аэрированием.
3) Комбинированные методы – обработка хлором совместно с другими бактерицидными препаратами. Применяют для усиления действия хлора. Это хлорирование с манганированием, хлорсеребряный и хлормедный способы, хлорирование с аммонизацией.
Озонирование
Озон впервые был применен для дезинфекции воды в конце 19 в во Франции. В России первая озонаторная установка была пущена в 1911 г в С.-Петербурге. Наибольшее количество озонаторных установок в Швейцарии – 24 на 1млн населения (в России – 0,02 на 1 млн. населения).
В природе озон образуется при электрических разрядах (молнии) и под действием УФ-радиации при 242 нм. Озон образуется из кислорода при пропускании через него малого электрического разряда.
3O2 = 2O3
В воде озон достаточно быстро распадается с образованием кислорода.
Озон является аллотропической модификацией кислорода и представляет собой бледно-фиолетовый газ, очень токсичный, с характерным запахом, обнаруживаемым даже при разбавлении 1:106. Основные преимущества использования озона для обеззараживания воды (по сравнению с хлором) объясняются его свойствами. Озон — более сильный окислитель, поэтому обладает высоким бактерицидным, вирулицидным действием, высокой степенью окисления органических веществ, эффективно реагирует с канцерогенными веществами, быстро окисляет железо и марганец, позволяет снизить цветность воды, улучшает цвет и запах, способствует повышению содержания кислорода.
Быстрое воздействие оказывает озон на вегетативные клетки бактерий и основную часть вирусов. Однако если в воде присутствуют легко взаимодействующие с озоном вещества, такие как соединения двухвалентного железа, гуминовые кислоты, одноатомные фенолы, их окисление предшествует инактивации бактерий и вирусов. Более устойчивы к действию озона спороносные бактерии. Из наиболее характерных органических примесей воды труднее окисляются фульвокислоты, нефтепродукты, СПАВ, пестициды. Озон энергично окисляет фенольные соединения, поэтому обработка озоном воды, содержащей фенолы, предпочтительнее, чем хлором.
Химизм обеззараживания воды озоном
Изучение констант прямых реакций озона с органическими загрязнителями воды при различных рН позволяет сделать следующие выводы:
Насыщенные алкилгруппы, присутствующие в алканах, не реагируют. Поэтому озонирование не применимо для
Олефиновые соединения (олеиновая кислота, стирол и др) реагируют в течение нескольких секунд. Однако, если атом водорода в альфа-положении к двойной связи С=С замещен атомом хлора, соединения становятся инертными. Поэтому перхлорэтилены не могут быть окислены во время озонирования за разумное время.
Бензол реагирует в течение нескольких дней. Однако полиароматические углеводороды, являющиеся канцерогенами, – за несколько секунд.
Фенолы окисляются за секунды. Фенолят-анион реагирует в 106 раз быстрее.\
Продуктами окисления при расщеплении системы ароматических колец являются глиоксалат-, малеинат-, ацетат- и формиат-ионы. Из них только формиат-ионы легко вступают в последующие реакции, остальные аккумулируются в воде и требуют других способов окисления.
Примеси аммиака, аминосоединений, солей аммония легко окисляются озоном с образованием гидроксиламинов, нитросоединений и др.
Прямые реакции озонирования высокоселективны. Они не применимы для окисления алканов, бензола, хлорированных органических соединений, однако разлагают высокотоксичные примеси, такие как полициклические ароматические углеводороды, фенольные соединения, свободные (не протонированные) амины, сульфиды.
Продукты реакции озонирования – различные альдегиды, кислоты и даже полимеры.
При окислении фенолов образуются вторичные загрязнители – непредельные альдегиды и кислоты, придающие воде неприятный запах, поглощающие кислород. Озон взаимодействует и с этими вторичными загрязнителями. Превращая их в предельные кислоты и далее вплоть до полного окисления до СО2 и Н2О. подобные реакции протекают при окислении гуминовых и фульвокислот.
Серусодержащие примеси (синтетические моющие средства, сероводород, диоксид серы, роданиды ) в воде составляют значительную долю примесей. Все они окисляются озоном. Наиболее активно взаимодействуют с озоном те из них, которые имеют связь C=S.
Наряду с окислением органических примесей при озонировании воды происходит окисление ионов металлов низких степеней окисления, находящихся в свободном состоянии или в виде комплексов. При этом образуются нерастворимые соединения, выпадающие в осадок.
Озон подавляет рост бактерий, вирусов, водорослей и др гидробионтов, является дезинфектантом.
Примеси, находящиеся в воде в динамическом равновесии, образуют эмульсии, которые стабилизируются ПАВ. Озон нарушает эти равновесия, выступая как флокулянт. Вызывает расслоение эмульсий и выпадение примесей в осадок.
Получение озона в промышленности
В промышленных условиях для получения озона используют генераторы озона — трубчатые озонаторы. Для производительной работы озонатора необходимы тщательная очистка и высушивание используемого кислорода или воздуха и обязательное его охлаждение.
Для смешения озоно-воздушной смеси с обрабатываемой водой в зависимости от качества воды и производительности установки применяют барботажное перемешивание, механические турбинные смесители, водоструйные насосы и эжекторы.
Расход озона, обеспечивающий обеззараживание воды, зависит от ее качества, концентрации озона в озоно-воздушной смеси, вида смесителя, температуры воды и других факторов. Необходимая доза озона при обеззараживании питьевых вод составляет 0,75— 3 мг/л. Концентрация остаточного озона после камер смешения поддерживается на уровне 0,1—0,3 мг/л.
Применение озона для обеззараживания сточных вод оправдано в тех случаях, когда по тем или иным причинам невозможно осуществлять хлорирование, например:
1) при наличии в сточной воде соединений, образующих с хлором вещества, усиливающие цветность, запах или токсичность воды;
2) при невозможности разместить склады с хлором на станции очистки ввиду близости жилого массива;
3) при комплексном использовании озона для обеззараживания воды и окисления вредных примесей, которые невозможно или экономически невыгодно устранять другими методами.
С целью уменьшения расхода озона целесообразно озонировать сточные воды после доочистки на микрофильтрах или на фильтрах. Дозы озона для обеззараживания сточных вод составляют 6—10 мг/л. Продолжительность контакта принимается равной 8—20 мин.
НЕДОСТАТКИ применения озона
1. Образование побочных продуктов окисления и их возможное воздействие на здоровье человека.
Так, при озонировании образуется ряд карбонильных соединений, содержание которых в воде нормируется: формальдегид (ПДК 0,05 мг/л), бензальдегид (ПДК 0,003 мг/л), ацетальдегид (ПДК 0,2 мг/л).
Анализ результатов токсикологических исследований позволяет сделать вывод, что обработка воды озоном может устранять, повышать или не влиять на мутагенную активность активность воды. Но при этом мутагенная активность остается наже, чем при хлорировании тех же образцов. Присутствие в воде пероксидов, эпоксидов и ненасыщенных альдегидов в воде не доказано, т.к. они подвержены биодеградации и быстро разлагаются при прохождении через распределительную сеть.
2. Озон не стабилен, поэтому возможен вторичный рост микроорганизмов в воде. При рН 7,6 и 20 град С озон в водопроводной сети разлагается менее, чем за 1 час. Поэтому только при небольшой протяженности сети и при низких температурах можно обойтись без дополнительной дезинфекции хлором.
3. Высокая энергоемкость озонирования.
4. Трудности при смешении озона с водой из-за большой разности в удельных массах и высокого поверхностного натяжения воды.
Для генерации озона используют устройства с барьерным электрическим разрядом и электролитические озонаторы.
Предварительное озонирование предпочтительнее, чем хлорирование, т.к. озон вызывает флокулирование и осаждение примесей, осаждает тяжелые металлы и разлагает большинство органических примесей; позволяет избежать образования токсичных хлоруглеродов. Типичная концентрация озона на этой стадии обработки воды составляет 0,4 г/м3 и экспозиция 5 мин. Для адсорбции образовавшейся органики воду обрабатывают активированным углем. Для заключительной дезинфекции воды достаточно использовать низкие дозы озона (менее 0,1 г/м3) из-за высокой обеззараживающей способности.
Озонирование можно сочетать с использованием перекиси и др. окислителей, с УФ-облучением, ультразвуком, фильтрацией с использованием песка, активированного угля, ионообменных смол.
Озон способен взаимодействовать с поверхностью активированного угля (АУ) Клименко Н.А., Савчина Л.А., Козятник И.П. и др. Влияние предварительного озонирования на биорегенерацию активированного угля при его непродолжительной эксплуатации // Журнал Химия и технология воды. – т. 31. – №4. – 2009. – С. 387–398].
1. При взаимодействии АУ с озоном повышается биодоступность растворенных органических веществ: озонирование может трансформировать биологически устойчивые органические соединения в такие, которые легко разлагаются. Например, ВМС под действием озона разлагаются на вещества с низкой молекулярной массой.
2. Под действием озона химически изменяется поверхность АУ: образуются гидроксильные (ОН–), карбоксильные (–СООН), карбонильные (–Сн=О) группы.
С участием поверхности АУ озон трансформируется в радикал ОН, что приводит к эффективному окислению примесей воды.