- •VI семестр лекция 1 Коагуляция и флокуляция
- •3. Доза коагулянта.
- •4. Флокулянты
- •Мицелла (коллоидная частица)
- •Лекция 2 Электрохимическое коагулирование
- •Лекция 3 Отстаивание
- •Лекция 4 Фильтрование
- •Лекция 5 Стабилизация воды систем водоснабжения
- •Лекция 6 железо в природных водах
- •Лекция 7 деманганация воды
- •VII семестр Лекция 8 Мембранная сепарация
- •Лекция 9 электродиализ
- •Лекция 10 Нейтрализация
- •Лекция 11 дистилляция. Эвапорация. Дегазация
- •Лекция 12 обеззараживание воды
- •Лекция 13 Ионный обмен
- •Лекция 14 экстракция
- •Дополнительные лекции
- •Лекция 1
- •Баромембранные явления, закономерности. Классификация мембран по размерам пор. Предварительная подготовка воды
- •Классификация мембран по размерам пор
- •Предварительная подготовка воды
- •Лекция 2
- •Лекция 3
Лекция 11 дистилляция. Эвапорация. Дегазация
Дистилляция – процесс разделения раствора на составные части путем перегонки. Если один из компонентов является нелетучим соединением, то необходимо ввести дистилляцию при температуре, соответствующей температуре кипения летучего компонента до полного отделения его от нелетучего.
Если оба компонента летучи, то в основе лежит различие в составах равновесных жидкостей и пара. Чем значительнее различаются по составу равновесные жидкость и пар, тем легче осуществляется разделение.
|
|
а |
б |
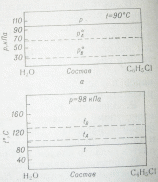
Рис. а – диаграмма «состав – температура кипения» двойных смесей б – диаграммы «состав – давление пара» и «состав – температура кипения» в системах из взаимно нерастворимых компонентов |
|
Рассмотрим случай разделения системы, для которой типична диаграмма состав-температура кипения (рис. ). Если нагревать раствор состава N1, то кипение его начнется при температуре t1 (точка С). Пар, равновесный с этим раствором, имеет состав N3 (точка D). Так как он богаче компонентом B, чем исходный раствор, то после некоторого испарения последнего концентрация компонента A в остатке возрастает и он уже имеет состав N2. Раствор такого состава кипит уже при температуре t2. Пар, находящийся в равновесии с этим раствором, имеет состав N4, который также богаче компонентом B, чем раствор. Таким образом, остаток раствора обогащается компонентом A; в конце концов он будет содержать чистый компонент A и температура кипения достигнет tA.
Если же пар, выделившийся из раствора, например, пар состава N3, сконденсировать и конденсат вновь подвергнуть дистилляции, то он будет кипеть уже при температуре t3 и пар его еще более будет богат компонентом В (N5).
Продолжая процесс конденсации и дистилляции, можно в конечном результате достичь того, что весь пар будет представлять собой чистый компонент В. Таким образом, в системах этого типа любую двойную смесь можно разделить на чистые компоненты путем дистилляции, называемой фракционной перегонкой.
Если фракционная перегонка осуществляется в виде непрерывного процесса, в котором операции конденсации и дистилляции отдельных фракций автоматизированы, то эта форма процесса называется ректификацией, а аппарат – ректификационной колонной.
Если жидкости А и В взаимно нерастворимы, то общее давление пара их смеси р равно сумме давлений пара чистых компонентов рА0 и рВ0, а температура кипения смесей всех составов в такой системе будет постоянной, пока имеется хотя бы небольшое количество обеих жидких фаз. При этом температура кипения t всегда ниже температур кипения чистых компонентов tА и tВ.
Перегонка с водяным паром (эвапорация). Многие вещества не выдерживают нагревания до температуры кипения при атмосферном давлении, разлагаясь уже при более низких температурах. Такие вещества можно разделить методом перегонки их вместе с жидкостью, в которой они не растворимы. Перегонка будет происходить при температуре, при которой сумма давлений насыщенных паров компонентов станет равной внешнему (в частности, атмосферному) давлению. Обычно этот метод применяется для перегонки вместе с водой нерастворимых в ней органических веществ (например, фенолов).
Эвапорация осуществляется в аппаратах периодического действия или в непрерывно действующих периодических дистилляционных колоннах. Сточная жидкость протекает через колонну с насадкой навстречу острому пару, нагреваясь до 100С. При этом ее летучие примеси частично переходят в паровую фазу. Распределяясь между водой и паром согласно уравнению:
Сп/Св=К,
где Сп и Св – концентрации примеси в паре и воде соответственно, К – коэффициент распределения между паровой и жидкой фазами.
Величина К зависит от:
вид удаляемого вещества;
его концентрации в сточной жидкости. Однако в узких пределах, с которыми приходится иметь дело при очистке стоков, К принимается постоянным. Например, для 0,01…0,1 н растворов К составляет:
Аммиак 13 Анилин 5,5
Метиламин 11 Фенол 2
Этиламин 20 п-хлорфенол 1,3
Пар, прошедший эвапорационную колонну, поступает в скруббер, где освобождается от захваченных им загрязнений. Очистка от загрязнений осуществляется различными методами: так, для очистки от фенолов пар пропускают через нагретый раствор щелочи. В результате чего образуется товарный продукт – фенолят натрия.
Аэрирование сточной жидкости. Может выполнять две задачи:
десорбция растворенных летучих примесей (переход в газовую фазу);
окисление примесей и перевод их в состояние, подходящее для удаления из воды. Окисление кислородом воздуха примесей сточных вод протекает специфично для различных веществ и зависит от их концентрации. рН среды, температуры и т.д. Для установления оптимальных параметров проводят пробное аэрирование образца сточной жидкости.
Дегазация – удаление из воды растворенных газов. Наибольшее значение в технологии обработки воды имеют кислород, аммиак. Сероводород и углекислый газ.
Угольная кислота, кислород и сероводород обусловливают или усиливают коррозию металлов, а угольная кислота еще и бетона. Сероводород придает неприятный запах.
Обычно вода насыщается данными газами в результате специальных методов обработки (обезжелезивание, катионитное умягчение, ионитовое обессоливание приводит к образованию угольной кислоты).
Физические методы дегазации. Основаны на свойстве растворенных газов выделяться при увеличении поверхности контакта воды с воздухом или создании условий для пониженной растворимости газов в воде (понижение парциального давления газа над раствором, повышение температуры).
Первый способ – аэрирование – подходит для газов, парциальное давление которых в воздухе близко к нулю (свободная угольная кислота и сероводород). Парциальное давление кислорода в воздухе значительно, поэтому аэрированием его удалить невозможно.
Аэрирование осуществляется: дождеванием (высота падения 2-3 м), фонтанированием, барботажем воздуха через слой воды, пропусканием через градирни, разбрызгиванием в вакууме.
Второй способ – понижение растворимости газов в воде. Для этого применяют:
нагревание воды (термические деаэраторы);
понижение давления до величины, при которой вода кипит без дополнительного подогрева (вакуумные дегазаторы).
Химические методы. Основаны на химическом связывании растворенных газов.
1) фильтрование воды через окисляющиеся вещества.
Например, используют обеззараженные стальные стружки, загруженные в фильтр. При фильтровании железо, окисляясь, связывает кислород:
4Fe + 3O2= Fe2O3.
Образовавшиеся при коррозии стружек оксид и гидроксид железа удаляют обратной промывкой. Продолжительность контакта зависит от температуры воды (при увеличении температуры от 20 до 80 градусов время контакта снижается с 25 до 8 мин).
2) обработка воды сульфитом натрия
2Na2SO3 + O2 = 2Na2SO4
или сернистым газом (в качестве катализатора применяется медный купорос):
SO2 + H2O = H2SO3
2H2SO3 + O2 = H2SO4
Для удаления 1 мг кислорода расходуется 4 мг сернистого газа или 7,9 мг сульфита натрия.
3) Обработка гидразином (это лучший обескислороживающий реагент):
O2 + N2H4 = N2 + 2H2O
Катализаторами реакции являются металлическая медь, стекло, активный уголь. Недостаток – высокая стоимость гидразина.
4) окисление сероводорода хлором. В зависимости от дозы хлора проходит до свободной коллоидной серы или до серной кислоты.
Малые дозы хлора (до 2 мг хлора на 1 мг сероводорода) приводят к окислению до коллоидной серы:
Cl2 + H2S = 2HCl + S,
которую необходимо удалять.
Большие дозы хлора окисляют сероводород до серной кислоты:
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl.
Реакция протекает довольно медленно, применяется для небольших количеств сероводорода (например, остаточного после аэрирования).
5) удаление сероводорода гидроксидом железа (III) с последующей регенерацией сульфида железа. В щелочной среде протекает реакция:
2Fe(OH)3 + 3H2S = Fe2S3 + 6H2O
В нейтральной среде:
2Fe(OH)3 + 3H2S = 2FeS + S+ 6H2O
Вода при этом теряет специфический запах и коррозионные свойства, после отстаивания пригодна для технических целей. Для питьевых и хозяйственно-бытовых целей необходима добавка извести около 60 мг/л (100% известь) и последующее фильтрование для осветления воды.
Биохимический метод окисления сероводорода. Окисление серобактериями идет в 2 этапа (по С.Н. Виноградскому):
H2S + O2 = 2H2O + 2S + 527 кДж
2S + 3O2 + 2H2O = 2H2SO4 + 1168 кДж
Необходимая концентрация кислорода достигается аэрированием воды. Чтобы не происходило подавление деятельности серобактерий необходимо нейтрализовать серную кислоту. Для этого вода должна содержать достаточно карбонатов.
Удаление угольной кислоты (см. стабилизация воды).
В сточных водах дегазация осложняется многими факторами. Например, наличием поверхностных пленок (нефтяных, маслянистых и т.д.) и примесей, адсорбирующих газы.