- •VI семестр лекция 1 Коагуляция и флокуляция
- •3. Доза коагулянта.
- •4. Флокулянты
- •Мицелла (коллоидная частица)
- •Лекция 2 Электрохимическое коагулирование
- •Лекция 3 Отстаивание
- •Лекция 4 Фильтрование
- •Лекция 5 Стабилизация воды систем водоснабжения
- •Лекция 6 железо в природных водах
- •Лекция 7 деманганация воды
- •VII семестр Лекция 8 Мембранная сепарация
- •Лекция 9 электродиализ
- •Лекция 10 Нейтрализация
- •Лекция 11 дистилляция. Эвапорация. Дегазация
- •Лекция 12 обеззараживание воды
- •Лекция 13 Ионный обмен
- •Лекция 14 экстракция
- •Дополнительные лекции
- •Лекция 1
- •Баромембранные явления, закономерности. Классификация мембран по размерам пор. Предварительная подготовка воды
- •Классификация мембран по размерам пор
- •Предварительная подготовка воды
- •Лекция 2
- •Лекция 3
VI семестр лекция 1 Коагуляция и флокуляция
Коагуляция – процесс объединения коллоидных частиц друг с другом, сопровождающийся образованием крупных агрегатов и разрушением коллоидной системы.
Коагулянты – химические вещества, применяющиеся для коагуляции.
Коагулирующее действие солей обусловлено их гидролизом в воде и образованием ряда промежуточных гидроксидов. Роль данных коагулянтов сводится к следующему:
1) нейтрализация коллоидных частиц;
2) способствуют началу процесса укрупнения хлопьев вследствие собственной полимеризации.
Выделяют два принципа проведения коагуляции:
Объемная коагуляция – коагулянт равномерно распределяется во всем объеме камеры. Проводится в камерах хлопьеобразования.
Контактная коагуляция – коагуляция протекает на поверхности сорбента. При этом коллоидные и взвешенные примеси воды сближаются с частицами сорбента (сорбентом является либо зернистая загрузка фильтра, либо слой взвешенного осадка) и прилипают к их поверхности под действием молекулярных сил. Преимущества перед объемной коагуляцией: идет при меньших дозах коагулянта, меньше зависит от температуры и мутности воды.
Коллоидные растворы (их ещё называют золями) различаются по степени взаимодействия коллоидных частиц с дисперсионной средой: выделяют лиофильные и лиофобные системы. Если дисперсионной средой является вода, то они называются:
гидрофильные. Отличаются значительным взаимодействием между дисперсионной средой (водой) и дисперсной фазой, что сопровождается образованием сольватных (гидратных) слоев;
гидрофобные. Взаимодействие между дисперсионной средой (водой) и частицами дисперсной фазы проявляется незначительно.
По заряду частиц дисперсной фазы выделяют
положительно заряженные золи. Напр., золи гидроксидов металлов;
отрицательно заряженные золи. Например, золи гуминовых кислот, коллоидные частицы глин (их основу составляют гидроалюмосиликаты), придающие воде мутность.
Гидроалюмосиликаты по химической природе являются алюмокремниевыми кислотами (слабые кислоты) или их солями и диссоциируют с образованием сложного аниона и иона водорода или щелочного металла. Возникновение отрицательного заряда у частиц глин обусловлено данным процессом. Т.к. алюмокремниевые кислоты имеют малую степень диссоциации, то при снижении pH устойчивость коллоидных частиц глин уменьшается. И наоборот, при повышении щелочности воды устойчивость таких коллоидных частиц возрастает. Это объясняется тем, что ионы Н+, образующиеся при диссоциации алюмокремниевых кислот, замещаются катионами металлов, образуя соли с более высокой степенью диссоциации, чем исходные кислоты. В очень жестких водах коллоидные частицы глины могут иметь «+» заряд.
В зависимости от строения частиц дисперсной фазы различают:
1) типичные коллоидные системы (суспензоиды). Коллоидные частицы суспензоидов состоят из агрегатов молекул не растворимых в данной среде соединений. Такие системы являются гетерогенными (многофазными), т.к. они имеют поверхность раздела.
2) растворы ВМС (молекулярные коллоиды). Имеют молекулярную степень дисперсности, это устойчивые однофазные системы, но размер макромолекул настолько велик, что становится соизмеримым с размером частиц типичных коллоидных растворов. Молекулярные коллоиды образуют устойчивые, обратимые растворы. Для них характерно наличие сильного взаимодействия между макромолекулами и растворителем за счет образования сольватных (в воде ‑ гидратных) оболочек.
Заряд коллоидной частицы может возникать в результате избирательной адсорбции ионов из раствора, ионизации молекул дисперсной фазы (напр., кремниевой кислоты) под действием молекул дисперсионной среды, адсорбции из раствора молекул, способных к диссоциации.
Ионы, адсорбированные на поверхности нейтральной частицы (ядра) – потенциалопределяющие ионы (знак заряда частицы определяется знаком заряда потенциалопределяющих ионов). Из ионов электролита, содержащегося в окружающем растворе, адсорбируются те, которые имеют с поверхностью одинаковую или изоморфную с ней атомную группу и заряд. При этом на частице возникает заряд, который частично компенсируют противоионы, подходящие к заряженной поверхности из раствора. Часть из них образует вместе с потенциалопределяющими ионами плотный адсорбционный слой (толщина 10‑7 – 10‑8 см). Остальные противоионы образуют около частицы в растворе диффузный слой (толщина 10‑4 см), в котором ионы находятся под действием двух сил: силы электростатического притяжения потенциалопределяющими ионами, и силы диффузии, стремящейся распределить их равномерно в объеме. Так формируется двойной электрический слой (ДЭС). Диффузионный слой компенсирует заряд гранулы в покое. Однако существует броуновское движение, в результате которого частица перемещается, диффузионный слой вокруг неё деформируется, заряд частицы полностью не компенсируется.
Скачок потенциала на границе раздела адсорбционного и диффузного слоя называется – электрокинетический или -потенциал (дзета).
2. Механизм процесса коагуляции. Устойчивость коллоидных систем зависит от соотношения электростатических сил отталкивания и молекулярных сил притяжения, действующих между частицами (Ван-дер-Ваальсовы, лондоновские). Силы притяжения преобладают на очень малых и больших расстояниях, когда частица удалены друг от друга на расстояние, превышающее двойную толщину диффузного слоя. Электростатические силы отталкивания преобладают на средних расстояниях порядка эффективной толщины ионной атмосферы.
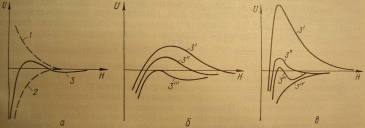
На рис. 2 приведены кривые потенциальной энергии отталкивания, энергии притяжения и результирующая в зависимости от расстояния между частицами.
|
Рис. 2. Зависимость энергии взаимодействия коллоидных частиц от расстояния между ними. а) – в обычном ионностабильном золе: 1 – энергия электростатического отталкивания, 2 – Энергия молекулярного притяжения. 3 – результирующая потенциальная кривая; б) – при нейтрализационной коагуляции (номера кривых возрастают с уменьшением 0-потенциала); в) – при концентрационной коагуляции (намера кривых возрастают с увеличением Z) |
1) если высота потенциального барьера (II) и глубина второго минимума (III) незначительна, то частицы сближаются и коагулируют в результате ближнего взаимодействия (I);
2) если высота потенциального барьера (II) значительна и глубина второго минимума (III) мала, то наблюдается агрегативная устойчивость системы.
Снижение -потенциала достигается:
1) введением электролита. Способность электролита вызывать коагуляцию увеличивается с увеличением валентности иона, обладающего зарядом, противоположным заряду коллоидных частиц. Чрезмерная доза электролита может привести к перезарядке коллоидных частиц и повышению устойчивости коллоидной системы;
2) введением коллоида, имеющего заряд частиц, противоположный заряду исходного коллоида. При этом происходит взаимная нейтрализация сталкивающихся между собой разноименно заряженных частиц.
ПРИМЕР Коагулянт – Al2(SO4)3. Сущность коагулирующего действия:
1) диссоциация и гидролиз сульфата алюминия с образованием труднорастворимых гидроксидов. Для увеличения степени гидролиза необходимо связывать образующиеся ионы Н+. Это достигается за счет естественной щелочности воды (щелочного резерва):
HCO3‑ + H+ CO2 + H2O
Если естественная щелочность недостаточна, то дополнительно вводят известь (Ca(OH)2) или соду (Na2CO3).
2) образование коллоидного раствора гидроксида алюминия. Золь гидроксида алюминия образуется вследствие большого разбавления и имеет положительный заряд вследствие адсорбции катионов Al3+, на коллоидной частице. Противоионами являются сульфат-анионы.
3) коагуляция золя гидроксида алюминия под действием анионов воды и его взаимодействие с коллоидными и грубодисперсными примесями воды.
Особенно быстро проходит процесс коагуляции золя гидроксида алюминия при рН 6,5‑7,5, соответствующем ИЭТ золя.
Скоагулировавшие частицы гидроксида алюминия имеют очень развитую поверхность и поэтому являются прекрасными адсорбентами для коллоидных примесей, содержащихся в воде. Максимальная адсорбция коллоидных частиц примесей воды происходит в начальный период формирования коагеля, т.е. в период скрытой коагуляции.
4) хлопьеобразование, завершающееся седиментацией. Чем быстрее растут хлопья, чем больше их масса и размер, тем интенсивнее идет седиментация, тем выше степень осветления воды.
Требуемое количество коагулянта в каждом случае определяется опытным путем.
Опытное или «пробное» коагулирование предусматривает проведение коагуляции пробы с повышающейся дозой коагулянта. Для этого берут набор стаканов светлого стекла, снабженных механической мешалкой, наливают в них исследуемую воду и вносят раствор коагулянта так, чтобы охватить достаточно большой диапазон доз. Включают мешалки на несколько минут (скорость вращения должна быть около 40 мин-1), после чего их выключают и вода отстаивается в условиях покоя*. Записывают результат визуального наблюдения степени коагуляции и хлопьеобразования — нет хлопьев, слабое хлопьеобразование, мелкие хлопья, хлопья средних размеров, хорошее хлопьеобразование и очень бурное образование хлопьев. В пробах определяется -потенциал и строятся зависимости «доза коагулянта — -потенциал» или «доза коагулянта — остаточная мутность» и т. п., по которым находят дозу коагулянта, обеспечивающую требуемый эффект обработки воды.
*) Стадии коагуляции: в начальный момент смешения коагулянта с водой никаких внешних изменений не наблюдается. Спустя некоторое время появляется опалесценция и вода мутнеет от образования огромного количества мельчайших хлопьев – до 5000 в 1мл (начало образования хлопьев). Эти хлопья агрегируются в более крупные, а число хлопьев в единице объема уменьшается. Когда оно достигает 5‑10 в 1 мл (конец хлопьеобразования), то начинается заметное осаждение хлопьев.