
- •Предмет - Теория химических процессов Студент - Лебедев Антон Сергеевич (Бакалавр) Тема - Материальные балансы Задание - matbal24
- •2) Определить число независимых реакций, выбрать независимые реакции и ключевые вещества
- •3) Записать уравнения суммарных независимых реакций образования ключевых продуктов
- •5) Вычислить селективность процесса по формальдегиду.
- •Тема - Вывод кинетических уравнений Задание - kinet13
- •Тема - Вывод кинетических уравнений Задание - kinet45
- •Тема - Кинетика и механизм радикальных реакций Задание - rad08
Тема - Вывод кинетических уравнений Задание - kinet45
Для следующей схемы элементарных стадий: A + K <=> AK
Y + AK K + B
AK + B C + K
C + K <=> CK
Вывести кинетическое уравнение, записать уравнение скоростей превращения по веществам А и В (-dCA/dt и dCB/dt), преобразовать их в концентрационную форму, как функцию только двух переменных (САи СВ), имея в виду, что CK << Ci,0 , равновесие устанавливается быстро и Ci,0 известны.
Катализатор
K
образует комплексы AK
и CK
по быстрым обратимым реакциям, что
позволяет воспользоваться выражениями
для констант равновесия для вычисления
их концентраций
 и
и
 .
.
Общая
концентрация катализатора сK
не меняется во времени и равна сумме
концентраций свободного катализатора
[K]
и его комплексов с А и C

Из записанных уравнений следует:

Отсюда:



Искомые изменения концентраций вещества A и B описываются уравнениями:

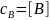
В дифференциальном виде
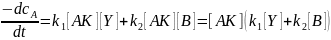

Для выражения концентрации Y через концентрации A и B запишем уравнения суммарных реакций, исключив концентрации катализатора и его комплексов, как не влияющих на уравнения материального баланса по реагентам ввиду малости концентрации катализатора (сi,0>>сK):
A + Y B
2A + Y C
Отсюда уравнения материального баланса имеют вид:


Подставив концентрации в приведенные выше кинетические уравнения, получим искомые уравнения:


Тема - Кинетика и механизм радикальных реакций Задание - rad08
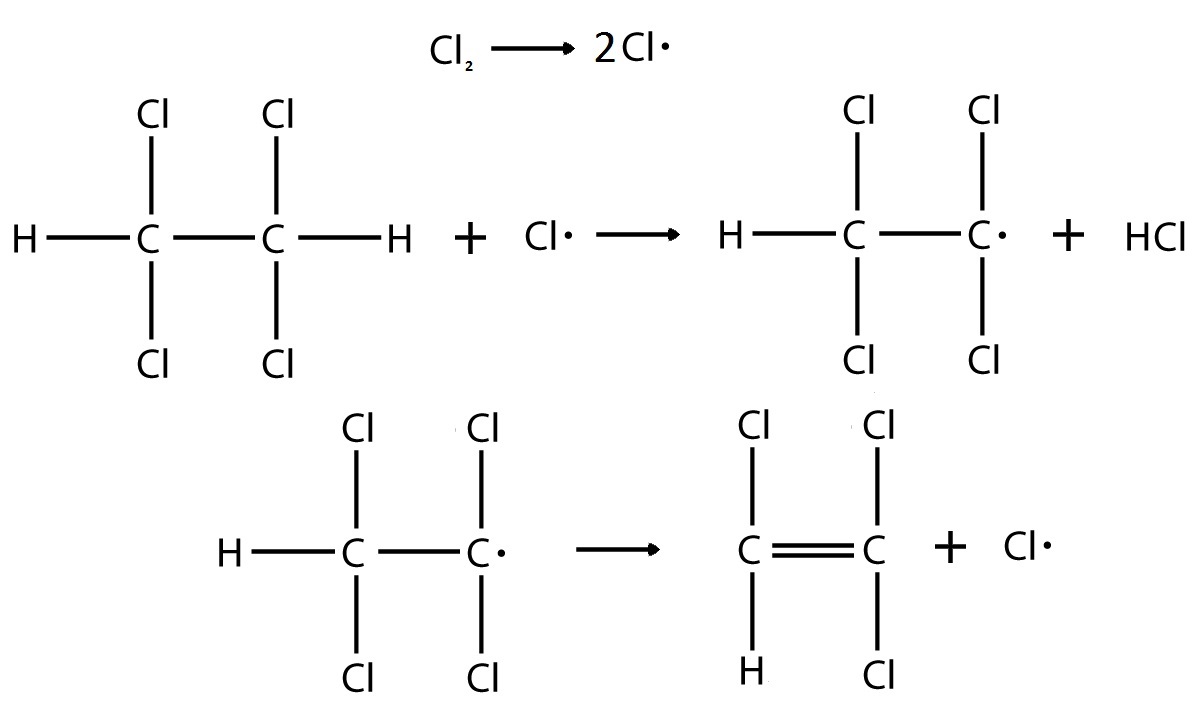
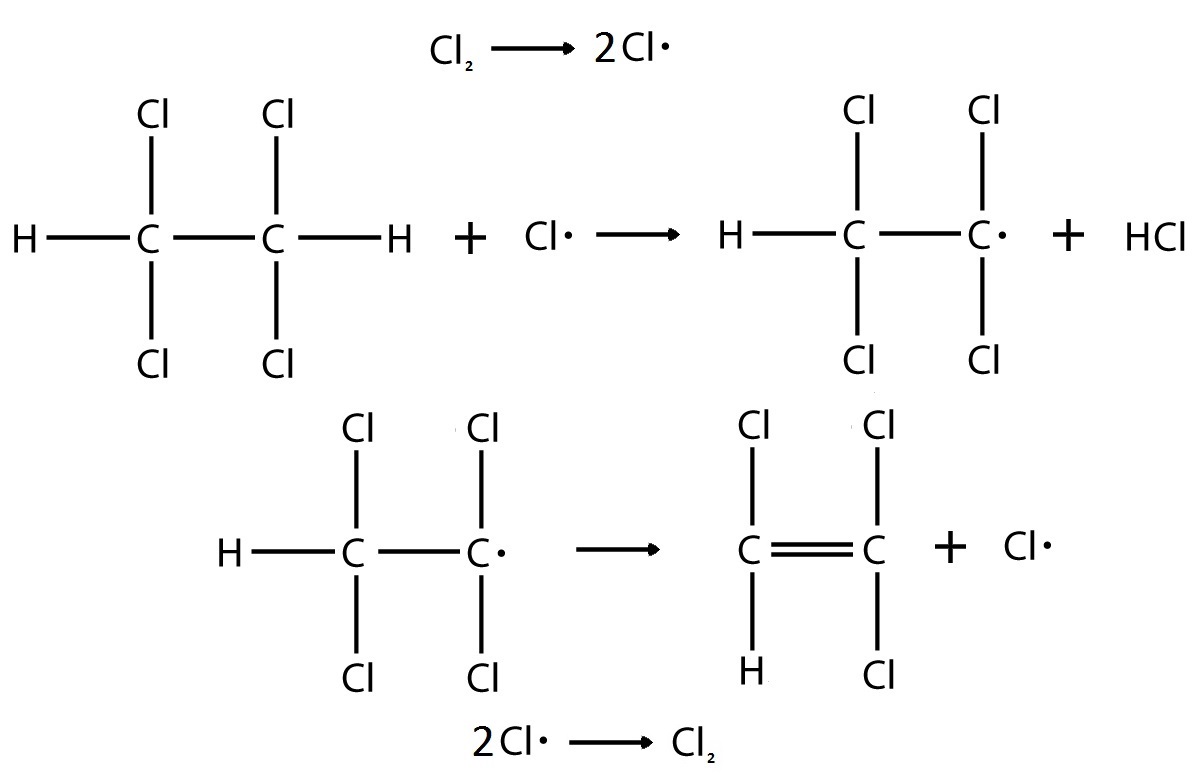
Вопрос №1 Напишите схему элементарных стадий и выражение для экспериментальной энергии активации реакции инициированного хлором дегидрохлорирования тетрахлорэтана через энергии активации стадий, если экспериментальное кинетическое уравнение имеет вид: r = k.[Cl2]0.5[Cl2CHCHCl2]
Вопрос №2 Выведите кинетическое уравнение термического бромирования толуола, учитывая, что одна из стадий развития цепи обратима: PhCH3 + Br. <=> HBr + PhCH2.
Вопрос №3 При длительном хранении на воздухе трет. бутилбромида образуется его изомер - BrСH2СН(СH3)2. напишите элементарные реакции этой изомеризации.
Вопрос №4 Как получить окись пропилена и уксусную кислоту из пропилена, ацетальдегида и воздуха?
Вопрос №1
Так как в экспериментальном кинетическом уравнении нет ни интенсивности излучения, ни концентрации инициатора, то можно предположить, что происходит термическое инициирование
k0
k1
k2
Откуда

Основной вопрос лишь в выборе реакции обрыва цепи, рассмотрим все варианты:
Допустим, что происходит квадратичный обрыв по радикалу хлора
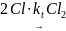
Тогда


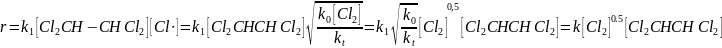
Данное уравнение аналогично данному в задании, следовательно, происходит квадратичный обрыв по радикалу хлора, и механизм реакции имеет следующие элементарные реакции:
k0
k1
k2
kt
Найдем выражение для экспериментальной энергии активации реакции
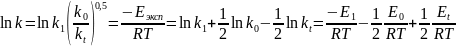
Умножив каждую часть уравнения на (–RT) получаем

где E1 – энергия активации реакции 1, E0 – энергия активации реакции инициирования, Et – энергия активации реакции обрыва цепи.
Вопрос №2
Б
k0
k1
k-1
ромирование толуола протекает по следующему механизмуО
k2
 стается
неизвестным лишь реакция обрыва цепи,
поэтому рассмотрим два варианта:
стается
неизвестным лишь реакция обрыва цепи,
поэтому рассмотрим два варианта:
1) квадратичный обрыв по атому брома

Тогда



Отсюда
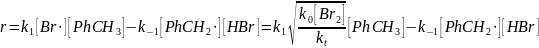
Найдем концентрацию бензильного радикала



После чего подставляем в полученное уравнение
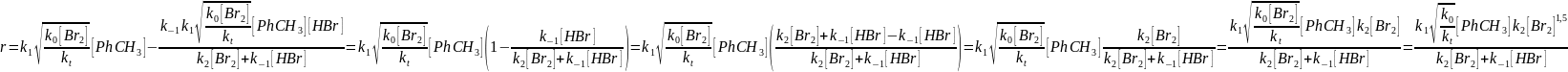
2) линейный обрыв по атому брома
Тогда


И в итоге получаем

В случае если равновесие устанавливается медленно и k-1 << k2, тогда получаем, что в случае квадратичного обрыва по радикалу брома кинетическое уравнение скорости реакции будет иметь вид

А в случае линейного обрыва по радикалу брома

Вопрос №3
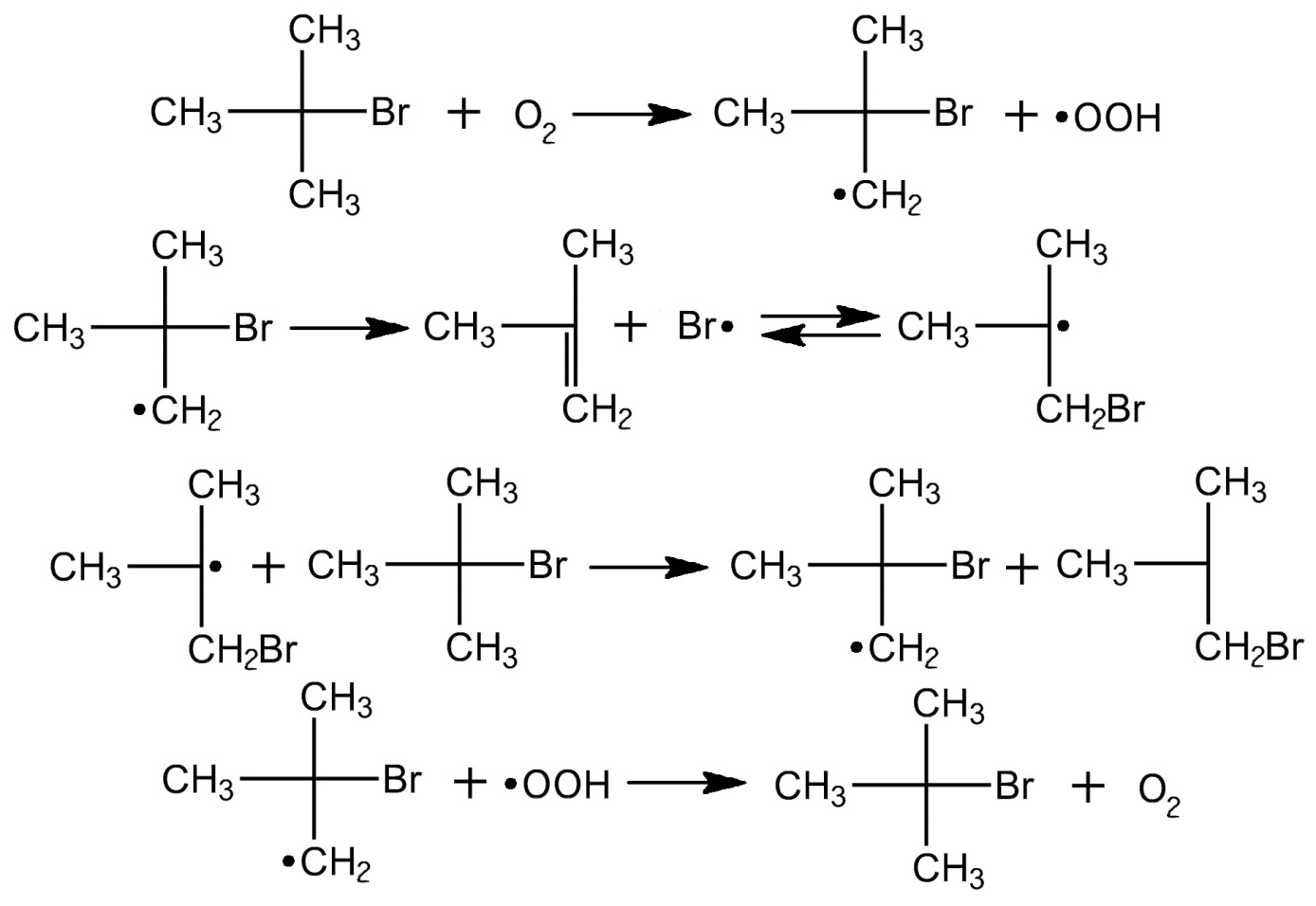
Вопрос №4

