
- •§11.3. Класифікація органічних сполук.
- •§12.1. Насичені вуглеводні. Алкани (парафіни).
- •§12.2.9. Одержання.
- •§12.2.13. Одержання.
- •Розділ 13. Кисневмісні органічні сполуки
- •§13.2.1. Одержання.
- •§11.1. Предмет органічної хімії
- •§11.2. Теорія будови органічних сполук. Ізомери Теорія будови органічних сполук а.М. Бутлерова:
- •§11.3. Класифікація органічних сполук
- •§11.4. Основні класи органічних сполук
- •§11.5. Номенклатура органічних сполук
- •Які вказуються лише у префіксі(за алфавітом)
- •§11.6. Класифікація реакцій в органічній хімії
- •§12.1. Насичені вуглеводні. Алкани
- •12.1.1. Гомологічний ряд алканів
- •12.1.2. Будова молекули Метану
- •12.1.3. Ізомерія
- •12.1.4. Одержання
- •3) Реакція Вюрца:
- •4) Відновленням карбону і його оксидів воднем:
- •5) Сплавленням солей карбонових кислот з лугами:
- •12.1.5. Фізичні властивості
- •12.1.6. Хімічні властивості
- •12.1.7. Застосування
- •§12.2 Ненасичені вуглеводні
- •12.2.1. Алкени. Гомологічний ряд алкенів.
- •12.2.2. Електронна будова подвійного зв’язку
- •12.2.3 Ізомерія
- •12.2.4. Одержання
- •5) Дегалогенування дигалогенпохідних (відщеплення галогену)
- •12.2.5. Фізичні властивості
- •12.2.6. Хімічні властивості
- •12.2.7. Застосування
- •12.2.8. Дієнові вуглеводні (алкадієни). Типи алкадієнів.
- •12.2.9. Одержання
- •12.2.10. Фізичні властивості
- •12.2.11. Хімічні властивості
- •Полімеризація дієнових сполук
- •12.2.12. Алкіни. Гомологічний ряд алкінів
- •12.2.13. Одержання
- •12.2.14. Електронна будова потрійного зв’язку
- •12.2.15. Фізичні властивості
- •12.2.16. Хімічні властивості
- •1) Гідрування:
- •2) Галогенування:
- •3) Гідрогалогенування:
- •12.2.17. Застосування
- •§ 2.3. Ароматичні вуглеводні (арени)
- •12.3.1. Будова молекули
- •12.3.2. Гомологи бензену. Ізомерія. Гомологи бензену можна розглядати як похідні бензену, в яких один або декілька атомів Карбону заміщені різними вуглеводневими радикалами.
- •12.3.3. Фізичні властивості
- •12.3.4. Хімічні властивості
- •● Реакції заміщення:
- •1) Галогенування
- •2) Галогенування
- •12.3.5. Правила орієнтації в бензеньному ядрі
- •Розділ 13. Кисневмісні органічні сполуки
- •13.1.1. Одноатомні спирти
- •Гомологічний ряд спиртів
- •Фізичні властивості
- •Одержання
- •Утворення алкоголятів:
- •2) Феноли утворюють: прості ефіри (етери)
- •13.3.2. Одержання
- •13.3.3. Хімічні властивості
- •3) Приєднання гідросульфіту натрію
- •13.3.4. Застосування
- •§13.4. Карбоксильні сполуки
- •13.4.1. Карбонові кислоти
- •Класифікація карбонових кислот
- •Номенклатура карбонових кислот
- •Ізомерія карбонових кислот
- •Одержання
- •2) Синтез оцтової кислоти:
- •Хімічні властивості
- •Застосування
- •13.4.2 Естери
- •Номенклатура естерів
- •Ізомерія
- •Фізичні властивості
- •Одержання
- •Хімічні властивості
- •Застосування
- •13.4.3. Генетичний зв’язок між вуглеводнями, спиртами, альдегідами і кислотами
- •13.4.4 Ліпіди (жири)
- •Класифікація
- •Номенклатура
- •Одержання
- •Перший синтез жиру здійснив Бертло (1854 р.) при нагріванні гліцерину і стеаринової кислоти:
- •Хімічні властивості
- •Застосування
- •Біологічна роль жиру у людському організмі
- •Розділ 14. Вуглеводи §14.1. Вуглеводи. Їх класифікація
- •Значення вуглеводів
- •§14.2. Вуглеводи-моносахариди. Будова. Ізомерія
- •14.2.1. Класифікація
- •14.2.2. Номенклатура Генетичний d- ряд сахаридів
- •Формули Хеуорса
- •Фізичні властивості
- •Одержання
- •Хімічні властивості
- •● Реакції по карбонільній групі
- •1) Алкілування (утворення простих ефірів) – атом водню гликозидного гідроксилу заміщується на 1 метильну групу.
- •2) Ацилювання (утворення складних ефірів).
- •● Специфічні реакції
- •14.3.1.Класифікація і номенклатура
- •14.3.2. Застосування
- •§14.4. Полісахариди
- •14.4.1. Крохмаль Будова молекули (розгалужений ланцюг):
- •Фізичні властивості
- •Хімічні властивості
- •Знаходження в природі
- •Застосування
- •14.4.2. Клітковина (целюлоза) Будова молекули (лінійний ланцюг):
- •Фізичні властивості
- •Хімічні властивості
- •Знаходження в природі
- •Застосування
- •Розділ 15. Нітрогеновмісні органічні сполуки
- •§15.1. Нітросполуки
- •15.1.1. Класифікація і номенклатура
- •15.1.2. Одержання
- •15.1.3. Хімічні властивості
- •15.1.4. Застосування
- •15.2.1. Класифікація
- •15.2.2. Номенклатура
- •15.2.3. Ізомерія
- •15.2.4. Фізичні властивості
- •15.2.5. Одержання
- •15.2.6. Хімічні властивості Основні властивості
- •15.2.7. Застосування амінів
- •§15.3. Амінокислоти
- •15.3.1. Класифікація амінокислот
- •15.3.2. Ізомерія
- •15.3.4. Фізичні властивості амінокислот
- •15.3.5. Одержання амінокислот
- •15.3.6. Хімічні властивості
- •Біполярний йон
- •15.4.1. Склад і будова молекули
- •15.4.2. Поширення в природі
- •15.4.3. Хімічні властивості
- •Заняття №37 Тема: Поняття про органічні сполуки. Теорія хімічної будови органічних сполук о. М. Бутлерова. Електронна природа зв'язків. Класифікація і номенклатура органічних сполук
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №38 Тема: Насичені вуглеводні. Алкани. Будова, хімічні властивості, застосування насичених вуглеводнів
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №39 Тема: Ненасичені вуглеводні. Π-зв’язок. Алкени. Алкадієни. Алкіни. Хімічні властивості та застосування. Реакція полімеризації. Полімери. Одержання, властивості і застосування пластмас
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №40 Тема: Ароматичні вуглеводні. Системи спряження. Правила орієнтації в ароматичному ядрі
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №41 Тема: Контрольна робота №5
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №42 Тема: Кисневмісні сполуки. Спирти. Будова, властивості, застосування насичених одноатомних спиртів. Багатоатомні спирти
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №43 Тема: Ароматичні спирти і феноли. Структура, властивості, застосування. Генетичний зв'язок між спиртами і вуглеводами
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №44 Тема: Альдегіди. Будова карбонільної групи. Реакції приєднання та окиснення
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Самостійна позааудиторна робота студентів:
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №46 Тема: Зв’язок між вуглеводнями, спиртами, кислотами. Взаємозв’язок між класами органічних сполук
- •Самостійна позааудиторна робота студентів:
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №47 Тема: Контрольна робота №6
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №48
- •Лабораторна робота №6.
- •Тема: Ароматичні вуглеводні.
- •Властивості бензину та його гомологів
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Дослід 2. Дія бромної води і калій перманганату на бензен.
- •Заняття №49 Лабораторна робота №7. Тема: Спирти і альдегіди
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Заняття №50 Лабораторна робота №8. Тема: Карбонові кислоти
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Заняття №51 Лабораторна робота №9 Тема: Взаємозв’язок між класами органічних сполук
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Заняття №52 Тема: Складні ефіри. Жири як естери. Хімічні властивості жирів
- •Самостійна позаудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №53 Тема: Вуглеводи. Класифікація вуглеводів. Моносахариди
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №54 Тема: Ди- і полісахариди
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №55 Тема: Нітрогенвмісні сполуки. Аміни
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №56 Тема: Амінокислоти. Пептиди. Білки. Контрольна робота №7
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Додатки
- •Класифікація оксидів
15.3.4. Фізичні властивості амінокислот
Амінокислоти є безбарвними кристалічними речовиновинами, легко розчинними у воді, гірше — в органічних розчинниках. Деякі з них є солодкими на смак. Температури плавлення амінокислот як цвіттер-йонів є досить високими, деякі з них плавляться з розкладом. Природні α-амінокислоти (крім гліцину) є оптично активними речовинами.
15.3.5. Одержання амінокислот
Найбільш важливими є способи одержання амінокислот з галогенкарбонових кислот. Синтез відбувається в 2 стадії:
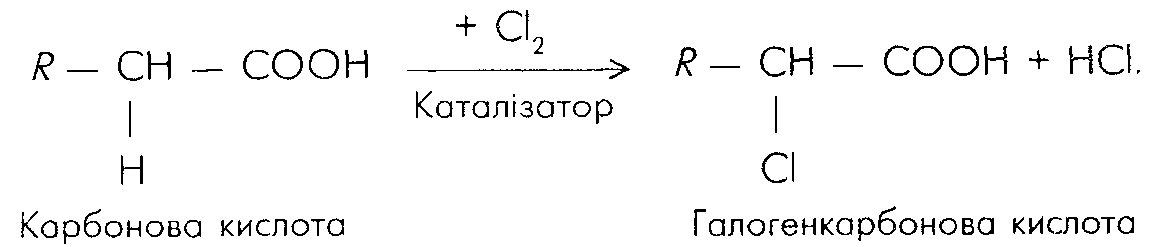

15.3.6. Хімічні властивості
1) α-амінокислоти є амфотерними сполуками, тому вступають у реакції з лугами і кислотами, утворюючи солі:
з лугами (pеакція заміщення ):

натрієва сіль гліцину
з кислотами (реакція приєднання):
|
|
|
або |
||
гідрогенхлоридна сіль гліцину |
||
2) кислотна (–COOH) і основна (–NH2) групи в молекулі амінокислоти взаємодіють одна з одною, утворюючи внутрішні солі (біполярні йони). Наприклад, для гліцину:
Біполярний йон
Положення рівноваги залежить від pH середовища. В ізоелектричній точці (ІЕТ), коли концентрація катіонів та аніонів рівні, конценотрація біполярного іона максимальна і рух його в електричному полі не відбувається.
3) α-амінокислоти вступають одна з одною в реакцію поліконденсації (реакція між ─СООН групою першої кислоти і ─NH2 групою другої кислоти). Продукти такої конденсації називаються ПЕПТИДАМИ. При взаємодії двох амінокислот утворюється дипептид:
H2N – |
H I CH – |
O H II I C – OH + H – N – |
CH3 I CH – |
O II C – OH |
|
гліцин |
аланін |
||
H2N – |
H I CH – |
O H II I C – N |
CH3 I – CH – |
O II C– OH + H2O |
|
гліцилаланін |
(Глі-Ала) |
||
При конденсації трьох амінокислот утворюється трипептид і т.д.
Зв'язок – |
O H II I C – N – називається ПЕПТИДНИМ зв'язком. |
Загальнi хiмiчнi властивостi амiнокислот визначаються реакцiйною здатнiстю їх рiзних функцiональних груп:
За карбоксильною групою вони утворюють солi, складнi ефіри, ангiдриди, галогенангiдриди, амiди кислот. У реакцiях декарбоксилування утворюються спирти з гiдроксикислот та амiни з амiнокислот.
За групою -NН вiдбуваються реакцiї ацилування, алкiлулування, дезамiнування.
15.3.7. Застосування та біологічне значення
Амінокислоти мають надзвичайно велике значення в органічному світі – з них побудовані важливі для живого організму білкові речовини (що виконують ряд інших важливих функцій в: структурні білки, ферменти, гормони, транспортні білки, захисні, запасаючі, скорочувальні, токсини).
У складі білків харчових продуктів людина отримує всі необхідні амінокислоти.
Генетичним кодом живих істот кодуються лише 20 амінокислот, в природі їх знайдено близько ста. деякі з 20-ти пртеїногенних амінокислот називаються «незамінними» — це такі, що не виробляються в організмі і мають бути отримувані з харчами. для людини це лізин, лейцин, ізолейцин, метіонін, фенілаланін, треонін, триптофан, валін, а для дітей також гістидин та аргінін.
У медицині для харчування важкохворих і як ліки.
§15.4. Пептиди. Білки
ПЕПТИДИ і БІЛКИ – це високомолекулярні органічні сполуки (біополімери), побудованими із залишків α-амінокислот, які сполучені між собою пептидними зв'язками (–СО–NH–). |
Умовно вважають, що пептиди містять в молекулі до 100 (відповідає молекулярній масі до 10000), а білки – понад 100 амінокислотних залишків (молекулярна маса від 10000 до декілька мільйонів).

