
- •Пояснительная записка
- •I. Инструктаж по технике безопасности
- •Лаборатория фхма тгпгк: назначение, требования техники безопасности
- •1.2. Общие правила проведения лабораторных работ
- •1.3. Правила техники безопасности
- •В лаборатории запрещается принимать пищу, пробовать на вкус и нюхать реактивы.
- •1.4. Правила противопожарной безопасности
- •1.5. Оказание первой помощи при несчастных случаях
- •Лабораторная работа № 1 «Колориметрическое определение меди»
- •Аппаратура и реактивы:
- •Лабораторная работа № 2 «Изучение устройства приборов кфк-2, кфк-3.Порядок их работы»
- •Аппаратура и реактивы:
- •Определение содержания окрашенных компонентов на колориметре фотоэлектрическом концентрационном кфк-2
- •Определение содержания окрашенных компонентов на колориметре фотоэлектрическом концентрационном кфк-3
- •Лабораторная работа № 3 «Выбор условий фотометрического определения»
- •3. Определение неизвестной концентрации раствора
- •Лабораторная работа № 4 «Определение содержания железа (III)в исследуемом растворе на фотометре кфк-3-01 (контрольная задача)»
- •Устройство рефрактометра ирф-454 б2м, порядок работы
- •Принцип действия
- •Оптическая схема
- •Конструкция
- •Рефрактометрическое измерение
- •Рефрактометрический фактор
- •Порядок рефрактометрических определений
- •Лабораторная работа № 6 «Определение концентрации ионов водорода»
- •Электрохимические методы анализа
- •1. Потенциометрические методы
- •1.1. Прямая потенциометрия (ионометрия)
- •Определение рН природной воды
- •Лабораторная работа № 7 «Потенциометрическое титрование. Определение титра соляной кислоты»
- •Расчетный и графический способы обнаружения к т т.
- •Кислотно-основное титрование
- •Лабораторная работа № 8 «Определение уксусной кислоты»
- •Лабораторная работа № 9 «Количественное определение солей с применением ионообменной хроматографии»
- •Практическое занятие № 1 «Количественное определение концентрации серосодержащих соединений с помощью газовой хроматографии»
- •Общие сведения
- •2. Хроматографические колонки
- •3. Детекторы
- •Принцип действия пфд
- •Методы расчета хроматограмм
- •Метод определения сероводорода, метил- и этилмеркаптанов
- •Гpадуировка хроматографа
- •Проверочная работа
- •Определение титра щевелевой кислоты
- •Определение уксусной кислоты.
- •Определение ацетата натрия методом ионообменной хроматографии
- •Вопросы и задачи
Лабораторная работа № 3 «Выбор условий фотометрического определения»
Цели:
1.Получить представление о сущности и порядке выбора условий фотометрического определения.
2.Научиться выбирать условия фотометрического определения исследуемого компонента.
3.Приобрести навыки исследования растворов фотометрическим методом.
4. Приобрести навыки построения градуировочного графика
Общие сведения
Фотометрическое определение компонентов следует проводить при условиях, обеспечивающих полноту образования поглощающего (окрашенного) соединения в растворе, отсутствие (или минимизацию) отклонения от основного закона светопоглощения, наибольшую точность и чувствительность анализа.
Выбор длины волны светового потока (λ). Для измерения светопоглощения исследуемого раствора выбирают длину волны светового потока, соответствующую максимуму полосы поглощения, для чего измеряют оптическую плотность раствора при разных длинах волн и строят график зависимости A=f(λ)- спектр поглощения. Работа в области максимума поглощения обеспечивает наибольшую чувствительность и точность определения.
Для монохроматизации светового потока в фотометрах применяют дифракционные решетки, обеспечивающие излучение определенного интервала длин волн с большей разрешающей способностью (0,1 нм).
Для монохроматизации светового потока в фотоэлектроколориметрах применяют набор светофильтров. Светофильтры — это специальные стекла, пропускающие излучение определенного интервала длин волн (20—60 нм). Для количественного анализа исследуемого компонента по светопоглощению выбирают светофильтр, пропускающий излучение, которое исследуемый компонент поглощает, т. е. минимум поглощения света светофильтром должен совпадать с максимумом поглощения раствора. В видимой части спектра воспринимаемый цвет есть результат избирательного поглощения веществом определенного участка сплошного спектра электромагнитного излучения (белого света). Цвет раствора всегда является дополнительным к цвету поглощенного излучения (табл. 1).
Таблица 1. Наблюдаемые цвета и соответствующие им поглощенные участки спектра
-
Интервал длин волн
поглощенного излучения,
нм
Цвет поглощенного
излучения
Наблюдаемый цвет (дополнительный цвет)
380—420
Фиолетовый
Желто-зеленый
420—440
Синий
Желтый
440—470
Голубой
Оранжевый
470—500
Голубовато-зеленый
Красный
500—520
Зеленый
Пурпурный
520—550
Желто-зеленый
Фиолетовый
550—580
Желтый
Синий
580—620
Оранжевый
Голубой
620—680
Красный
Голубовато-зеленый
680—780
Пурпурный
Зеленый
Цвет светофильтра является дополнительным к цвету раствора и соответствует участку спектра электромагнитного излучения, который этим светофильтром пропускается.
Оптимальный диапазон измерения оптической плотности (светопропускания). Фотометрические приборы имеют определенную погрешность измерения оптической плотности (светопропускания), что приводит к погрешности ∆С определения концентрации С исследуемого компонента в растворе. Минимальная относительная погрешность ∆C /C получается, когда оптическая плотность исследуемого раствора находится в интервале 0,1 — 1,0.
Толщина поглощающего слоя. В соответствии с уравнением Бугера — Ламберта —- Бера увеличение толщины поглощающего слоя b позволяет понизить предел обнаружения исследуемого вещества при прочих равных условиях. Однако при толщине поглощающего слоя больше 5 см возрастают потери на рассеяние света. Поэтому для фотометрирования растворов обычно используют кюветы с толщиной поглощающего слоя 1—5 см.
Условия проведения фотометрической реакции. В результате проведения фотометрической реакции исследуемый компонент переводят в окрашенное соединение:
Исследуемое вещество + Реагент = Окрашенное соединение
Количество образовавшегося окрашенного соединения эквивалентно количеству исследуемого вещества. Поэтому количество исследуемого вещества определяют путем измерения светопоглощения полученного окрашенного соединения. Чем больше концентрция
Условия проведения фотометрической реакции должны обеспечивать полноту образования и устойчивость получающегося окрашенного соединения.
На образование окрашенного соединения существенное влияние оказывает рН. Для выбора оптимального значения рН необходимо изучить влияние рН на интенсивность окраски раствора при постоянных концентрациях исследуемого вещества в реагенте. Интенсивность окраски измеряют при длине волны, соответствующей максимальному поглощению раствора. Значение рН выбирают таким образом, чтобы достигалось по возможности максимальное светопоглощение. При этом наиболее благоприятными условиями для фотометрического определения являются такие, когда небольшие изменения рН практически не влияют на светопоглощение. Постоянное значение рН в фотометрируемом растворе поддерживают при помощи буферных растворов.
Реагент добавляют к исследуемому веществу в количестве, достаточном для обеспечения полного перевода определяемого компонента в окрашенное соединение. Оптимальной концентрацией реагента является такая концентрация, выше которой дальнейшее добавление реагента не увеличивает выхода поглощающего соединения (т. е. не увеличивает светопоглощения раствора) на верхней границе диапазона определяемых содержаний исследуемого компонента
Интенсивность окраски может изменяться во времени, поэтому надо исследовать зависимость A =f (τ), на основании которой установить оптимальное время для проведения фотометрической реакции (рис.4).
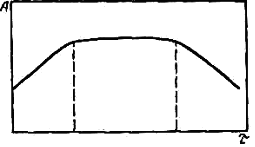
Рис. 4. График зависимости оптической плотности А от продолжительности фотометрической реакции τ
Подчинение основному закону светопоглощения. Подчинение основному закону светопоглощения полученного при реакции окрашенного соединения является основным условием для количественного фотометрического определения. Подчинение окрашенного соединения закону Бугера —Ламберта— Бера в данном диапазоне концентрации проверяют следующими способами:
1. Построение градуированного графика зависимости А — f(С) при выбранной длине волны λ. Если раствор подчиняется основному закону светопоглощения, то график в координатах А—С представляет собой прямую линию, проходящую через начало координат (рис. 4).
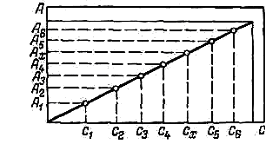
Рис.4. Градуировочный график зависимости оптической плотности от концентрации А — f(С)
2. Построение графика зависимости оптической плотности от длины волны для растворов различных концентраций. Если раствор подчиняется основному закону светопоглощения, то получают серию кривых одинаковой формы, независимо от толщины слоя раствора или концентрации вещества в растворе, сохраняющих положение максимума поглощения при одной и той же длине волны (рис. 5).
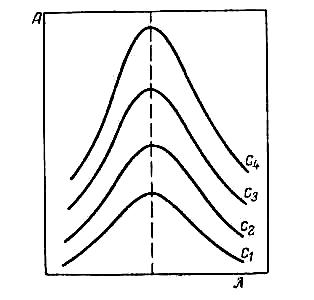
Рис.5 . Зависимость оптической плотности А от длины волны λ при различных концентрациях вещества в растворе (С4>С3>С 2>С1 )
Аппаратура и реактивы
Фотометр КФК-3-01;
Стандартный раствор перманганата калия KMnO4, содержащий 0,1 мг марганца в 1см3;
Стандартный раствор дихромата калия К2Сг2О7, содержащий 0,2 мг хрома в 1 см3;
Серная кислота, разбавленная (1 : 1);
Мерные колбы вместимостью 50,0 см3,
Бюретки, мерные цилиндры, градуировочные пипетки.
Требования техники безопасности
Перед выполнением лабораторной работы студенты должны получить инструктаж у преподавателя по технике безопасности при проведении химических анализов. Каждый студент должен расписаться в журнале по технике безопасности.
Ход выполнения работы
Перед началом работы необходимо познакомиться с порядком подготовки прибора КФК-3-01 к работе и правилами работы на нем.
1.Выбор длины волны светового потока λ.
По указанию преподавателя в мерную колбу вместимостью 50 см3 вводят
10 см3 стандартного раствора перманганата калия КМпО4 или 10 см3стандартного раствора дихромата калия К2Сг207, 5 см3 серной кислоты, разбавленной (1 : 1) и добавляют до метки дистиллированную воду. Измеряют оптическую плотность раствора, меняя длину волны, толщина поглощающего слоя 20 мм. На фотометре КФК-3-01снимают спектр поглощения в видимой области спектра (от 400 до 700 нм). Данные сводят в таблицу 2 и по этим данным строят кривые поглощения, выбирают оптимальную длину волны.
Таблица 2. Оптическая плотность раствора (дихромата калия или перманганата калия)
|
Длина волны, нм |
|||||
λ,нм |
|
|
|
|
|
|
А1 |
|
|
|
|
|
|
А2 |
|
|
|
|
|
|
А3 |
|
|
|
|
|
|
А ср |
|
|
|
|
|
|
2.Выбор толщины поглощающего слоя. По указанию преподавателя в мерную колбу вместимостью 50см3 вводят 10см3 стандартного раствора перманганата калия КМпО4 или 10см3 стандартного раствора дихромата калия К2Сг207, 5 см3 серной кислоты, разбавленной (1 : 1) и добавляют до метки дистиллированную воду. Измеряют оптическую плотность раствора при выбранной длине волны в кюветах с разной толщиной поглощающего слоя. Данные сводят в таблицу 3 и по этим данным выбирают рабочую длину кюветы.
Таблица 3 Выбор толщины поглощающего слоя
№ п/п |
Оптическая плотность раствора при толщине поглощающего слоя |
|||
1 см |
2 см |
3.см |
5 см |
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
А ср |
|
|
|
|
