
- •Пояснительная записка
- •I. Инструктаж по технике безопасности
- •Лаборатория фхма тгпгк: назначение, требования техники безопасности
- •1.2. Общие правила проведения лабораторных работ
- •1.3. Правила техники безопасности
- •В лаборатории запрещается принимать пищу, пробовать на вкус и нюхать реактивы.
- •1.4. Правила противопожарной безопасности
- •1.5. Оказание первой помощи при несчастных случаях
- •Лабораторная работа № 1 «Колориметрическое определение меди»
- •Аппаратура и реактивы:
- •Лабораторная работа № 2 «Изучение устройства приборов кфк-2, кфк-3.Порядок их работы»
- •Аппаратура и реактивы:
- •Определение содержания окрашенных компонентов на колориметре фотоэлектрическом концентрационном кфк-2
- •Определение содержания окрашенных компонентов на колориметре фотоэлектрическом концентрационном кфк-3
- •Лабораторная работа № 3 «Выбор условий фотометрического определения»
- •3. Определение неизвестной концентрации раствора
- •Лабораторная работа № 4 «Определение содержания железа (III)в исследуемом растворе на фотометре кфк-3-01 (контрольная задача)»
- •Устройство рефрактометра ирф-454 б2м, порядок работы
- •Принцип действия
- •Оптическая схема
- •Конструкция
- •Рефрактометрическое измерение
- •Рефрактометрический фактор
- •Порядок рефрактометрических определений
- •Лабораторная работа № 6 «Определение концентрации ионов водорода»
- •Электрохимические методы анализа
- •1. Потенциометрические методы
- •1.1. Прямая потенциометрия (ионометрия)
- •Определение рН природной воды
- •Лабораторная работа № 7 «Потенциометрическое титрование. Определение титра соляной кислоты»
- •Расчетный и графический способы обнаружения к т т.
- •Кислотно-основное титрование
- •Лабораторная работа № 8 «Определение уксусной кислоты»
- •Лабораторная работа № 9 «Количественное определение солей с применением ионообменной хроматографии»
- •Практическое занятие № 1 «Количественное определение концентрации серосодержащих соединений с помощью газовой хроматографии»
- •Общие сведения
- •2. Хроматографические колонки
- •3. Детекторы
- •Принцип действия пфд
- •Методы расчета хроматограмм
- •Метод определения сероводорода, метил- и этилмеркаптанов
- •Гpадуировка хроматографа
- •Проверочная работа
- •Определение титра щевелевой кислоты
- •Определение уксусной кислоты.
- •Определение ацетата натрия методом ионообменной хроматографии
- •Вопросы и задачи
Лабораторная работа № 7 «Потенциометрическое титрование. Определение титра соляной кислоты»
Цели:
1. Познакомиться с основами метода потенциометрического титрования.
2. Приобрести навыки потенциометрического титрования.
3. Определить титр раствора соляной кислоты.
Потенциометрическое титрование
Потенциометрическое титрование основано на регистрации изменения потенциала индикаторного электрода в процессе химической реакции между определяемым компонентом и титрантом. Конечную точку титрования (КТТ) находят по скачку потенциала, отвечающему моменту завершения реакции.
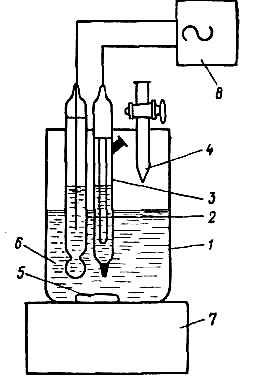 Рис.
11.
Установка
для потенциометрического титрования:
Рис.
11.
Установка
для потенциометрического титрования:
1 — стакан для титрования; 2 — индикаторный электрод; 3 — электрод сравнения; 4 — бюретка; 5 — мешатель; 6 — исследуемый раствор; 7 — магнитная мешалка; 8 — рН-метр-милливольтметр
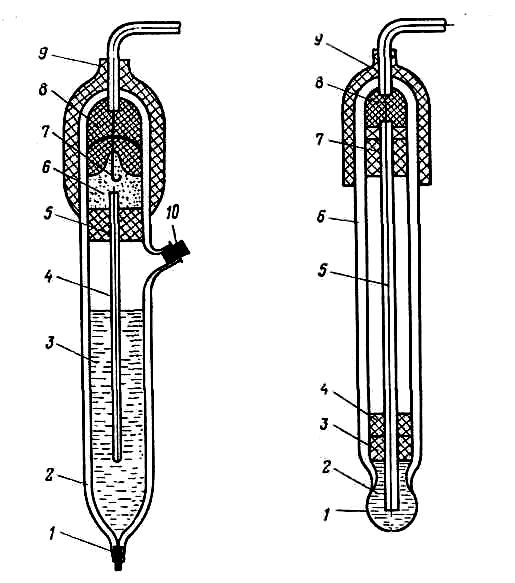
Рис.12. Хлорсеребряный электрод (типа ЭВЛ-1МЗ):
/ — нить асбестовая; 2 — корпус; 3 — насыщенный раствор КС1; 4- электролитический ключ; 5. 8 — резиновые пробки; 6 — полость; 7 — контактный полуэлемент; 9 — колпачок; 10 — пробка
Рис.13. Стеклянный электрод:
/ — мембрана; 2 — раствор; 3- парафин; 4, 7 — резиновые пробки: 5 — нить; 6— корпус; 8 — эпоксидный компаунд; 9 — колпачок
Электрод сравнения. Аg АgCl насыщ. КС1. Промышленность выпускает хлоридсеребряные электроды ЭВЛ-1МЗ, ЭВЛ-1М1.
Контактный полуэлемент 7 хлорсеребряного электрода рис.3 представляет собой серебряную проволоку с нанесенным на нее слоем хлорида серебра. Потенциал такого полуэлемента согласно уравнению Нернста:
Е= Е0 Ag+/Ag + 0,059/ n lg aAg+,
Потенциал хлоридсеребряного электрода опреляется активностью хлорид-ионов в растворе и является величиной постоянной, если стандартизуется концентрация раствора KCI. Хлорсеребряный электрод ЭВЛ-1МЗ применяют с точно насыщенным раствором КС1, его потенциал 201 мВ относительно стандартного водородного электрода.
Стеклянный электрод относят к ионоселективным электродам мембранного типа. Водородная функция стеклянных электродов объясняется особым химическим составом электродного стекла. На рис. 4показана конструкция стеклянного электрода. Стеклянный электрод имеет форму пробирки с тонкостенным шариком на конце (из специального электродного стекла), наполненную раствором 2 с постоянным рН. В этот раствор погружен хлорсеребряный электрод 5.
Перед работой стеклянный электрод выдерживают несколько часов в 0,1 М растворе HCI. При этом в поверхностные слои электродного стекла интенсивно проникают из раствора ионы водорода, вытесняя ионы содержащегося в стекле щелочного металла, например натрия, и в системе устанавливается равновесие. Равновесие нарушается, если поместить электрод в раствор с другим значением рН. Таким образом, электродная реакция стеклянного электрода не связана с переходом электронов, а сводится к обмену ионами водорода между стеклом (Н+ст) и раствором (Н+р-р):
Между стеклом и раствором возникает разность потенциалов, которая зависит от рН.
Уравнение Нернста для стеклянного электрода при температуре 298 К имеет вид:
Ест.эл = Е°ст.эл +0,059 lg aH+ = Е°ст.эл -0,059 рН,
где Ест.эл — потенциал стеклянного электрода; Е°ст.эл — константа, зависящая от состава стекла и других свойств стеклянного электрода.
Из этого уравнения следует, что потенциал стеклянного электрода линейно зависит от рН раствора. Интервал рН, в котором стеклянный электрод функционирует как водородный электрод, составляет обычно 0,5—12.
Серийно выпускаются стеклянные электроды для измерения рН ЭСЛ-ПГ-05; ЭСЛ-41Г-04; ЭСЛ-63-07, ЭСЛ-43-07.
Для измерения рН в исследуемый раствор помещают систему из двух электродов: стеклянного и электрода сравнения (например, хлорсеребряного электрода):
Ионоселективный электрод — это индикаторный электрод с относительно высокой специфичностью к отдельному иону или типу ионов. К ионоселективным относятся: 1) стеклянные электроды; 2) электроды на основе жидких ионитовых мембран; 3) электроды с твердыми ионитовыми мембранами (гомогенными и гетерогенными); 4) газовые электроды.
Техника работы. Сначала проводят ориентировочное титрование и находят объем титранта, приблизительно соответствующий КТТ, проводя следующие операции.
1. Прибор (рН-метр, иономер) приводят в рабочее состояние согласно описанию.
2. Полученный от преподавателя анализируемый раствор разбавляют до метки в мерной колбе и тщательно перемешивают.
3. Аликвоту раствора переносят пипеткой в чистый стакан вместимостью 100 - 150 см3, если это предусмотрено методикой, добавляют необходимые компоненты.
4. Стакан с раствором помещают в центр вращающегося столика для титрования, или на столик электромагнитной мешалки опускают в стакан индикаторный электрод и электрод сравнения, центрируют электроды.
5. Бюретку заполняют раствором титранта и закрепляют в штативе так, чтобы кончик бюретки был опущен в стакан, но не соприкасался с поверхностью титруемого раствора.
6. Включают мотор для вращения столика или мешалки и проводят ориентировочное титрование, прибавляя из бюретки по 1,00 см3 раствора титранта и измеряя Е (рН) после каждой его порции. Отсчеты ЭДС производят только после достижения постоянного значения (изменение ЭДС не должно превышать 2 - 3 мВ в течение 1 мин). Титрование продолжают до тех пор, пока изменение ЭДС или рН не достигнет своего максимального значения, а при дальнейшем прибавлении новых порций раствора реагента постепенно не уменьшится до малой величины. Результаты титрования записывают по форме, приведенной в таблице 1.
Таблица 1. Результаты ориентировочного титрования
|
||
Объем раствора тигранта V, см3 |
ЭДС, мВ (рН) |
∆мВ (∆рН) |
0- V |
|
|
Затем приступают к точному титрованию в области скачка Е (рН), для чего после тщательного промывания электрода сравнения и индикаторного электрода (или соответствующей обработки последнего в зависимости от выполняемой работы) в чистый стакан для титрования вносят новую аликвоту испытуемого раствора и выполняют операции, указанные выше. Затем к титруемому раствору прибавляют титрант в объеме V1 на 1 см3 меньше, чем это соответствует значению КТТ, найденному при ориентировочном титровании. После достижения постоянного значения потенциала (рН) продолжают титрование раствором реагента по каплям для нахождения КТТ при минимально возможном прибавляемом объеме титранта (число прибавляемых капель в порции приводится в описании определения для каждой выполняемой работы). Число капель диктуется величиной ожидаемого скачка потенциала: чем он больше, тем меньшими порциями титранта можно титровать (минимальный объем - одна капля). Запись результатов титрования ведут по форме, указанной в табл.2, выражая объем титранта числом капель. После достижения скачка Е (рН), как и прежде, убеждаются в уменьшении и малом изменении ∆Е (∆рН) при дальнейшем титровании по каплям. Отмечают общий объем затраченного титранта (V2).
Таблица 2. Результаты точного титрования
Объём раствора титранта V (капли) |
ЭДС,мВ (рН) |
∆ Е,мВ ∆рН |
V1 2к 4к …. V2 |
|
|
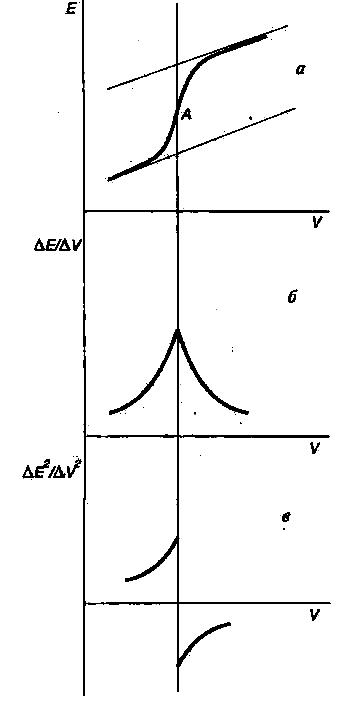
Рис.14. Кривые потенциометрического титрования:
а — интегральная; б — дифференциальная;
в — кривая по второй производной
