
- •Пояснительная записка
- •I. Инструктаж по технике безопасности
- •Лаборатория фхма тгпгк: назначение, требования техники безопасности
- •1.2. Общие правила проведения лабораторных работ
- •1.3. Правила техники безопасности
- •В лаборатории запрещается принимать пищу, пробовать на вкус и нюхать реактивы.
- •1.4. Правила противопожарной безопасности
- •1.5. Оказание первой помощи при несчастных случаях
- •Лабораторная работа № 1 «Колориметрическое определение меди»
- •Аппаратура и реактивы:
- •Лабораторная работа № 2 «Изучение устройства приборов кфк-2, кфк-3.Порядок их работы»
- •Аппаратура и реактивы:
- •Определение содержания окрашенных компонентов на колориметре фотоэлектрическом концентрационном кфк-2
- •Определение содержания окрашенных компонентов на колориметре фотоэлектрическом концентрационном кфк-3
- •Лабораторная работа № 3 «Выбор условий фотометрического определения»
- •3. Определение неизвестной концентрации раствора
- •Лабораторная работа № 4 «Определение содержания железа (III)в исследуемом растворе на фотометре кфк-3-01 (контрольная задача)»
- •Устройство рефрактометра ирф-454 б2м, порядок работы
- •Принцип действия
- •Оптическая схема
- •Конструкция
- •Рефрактометрическое измерение
- •Рефрактометрический фактор
- •Порядок рефрактометрических определений
- •Лабораторная работа № 6 «Определение концентрации ионов водорода»
- •Электрохимические методы анализа
- •1. Потенциометрические методы
- •1.1. Прямая потенциометрия (ионометрия)
- •Определение рН природной воды
- •Лабораторная работа № 7 «Потенциометрическое титрование. Определение титра соляной кислоты»
- •Расчетный и графический способы обнаружения к т т.
- •Кислотно-основное титрование
- •Лабораторная работа № 8 «Определение уксусной кислоты»
- •Лабораторная работа № 9 «Количественное определение солей с применением ионообменной хроматографии»
- •Практическое занятие № 1 «Количественное определение концентрации серосодержащих соединений с помощью газовой хроматографии»
- •Общие сведения
- •2. Хроматографические колонки
- •3. Детекторы
- •Принцип действия пфд
- •Методы расчета хроматограмм
- •Метод определения сероводорода, метил- и этилмеркаптанов
- •Гpадуировка хроматографа
- •Проверочная работа
- •Определение титра щевелевой кислоты
- •Определение уксусной кислоты.
- •Определение ацетата натрия методом ионообменной хроматографии
- •Вопросы и задачи
1. Потенциометрические методы
Потенциометрический метод анализа основан на измерении электродвижущей силы (ЭДС) обратимых гальванических элементов. Гальванический элемент состоит из двух электродов, индикаторного и электрода сравнения, погруженных в один раствор (цепь без переноса), либо в два различающихся по составу раствора, связанных жидкостным контактом (цепь с переносом).
В потенциометрии используют два класса индикаторных электродов.
1. Электроды, на межфазных границах которых протекают электронообменные процессы. Функционирование таких электродов основано на зависимости равновесного потенциала от состава и концентрации исследуемого раствора, описываемой уравнением Нернста:
Е= Е0 Ох/Red + 0,059/ n lg aOx / a Red,
где Е - равновесный потенциал
Е° - стандартный потенциал, равный равновесному, если активности всех участвующих в электрохимической реакции компонентов равны единице;
n - число электронов, участвующих в полуреакции.
aOx/ a Red -активности участвующих в электрохимической реакции компонентов
В основном это активные металлические электроды I рода (серебряный, медный, кадмиевый и др.) и инертные электроды (платиновый, золотой).
2. Электроды, на межфазных границах которых протекают ионообменные процессы - ионоселективные электроды (ИСЭ).
Различают прямую потенциометрию (ионометрию) - непосредственное измерение равновесного потенциала и нахождение активности ионов в растворе, и косвенную - потенциометричеcкое титрование - регистрация изменения потенциала в процессе химической реакции между определяемым веществом и титрантом.
В потенциометрическом титровании используют реакции основных типов: кислотно-основные, окислительно-восстановительные и комплексообразования, а также процессы осаждения.
Индикаторный электрод выбирают в зависимости от типа химической реакции и природы потенциалопределяющих ионов.
1.1. Прямая потенциометрия (ионометрия)
Для измерения ЭДС гальванических элементов с ИСЭ наиболее часто используют электронные вольтметры с высоким входным сопротивлением (иономеры, рН-метры) различных марок.
При работе с ИСЭ необходима его предварительная калибровка - установление зависимости между потенциалом электрода и активностью или концентрацией определяемых ионов. Для построения градуировочного графика в координатах E—pat (E—pci) используют стандартные растворы определяемых соединений.
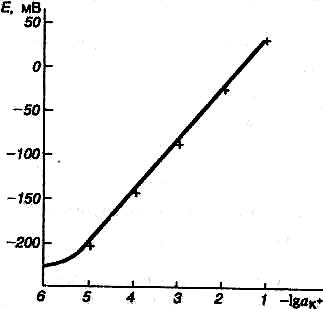
Рис. 10. Вид электродной функции
для калий-селективного электрода
Наиболее часто применяют прием последовательного разбавления исходного раствора дистиллированной водой. При этом считается, что коэффициент активности изучаемого иона либо известен, либо может быть легко вычислен.
Определение рН природной воды
Природная вода имеет щелочную реакцию среды, что обусловлено содержанием в ней анионов НСОз2-, СО32-, ОН-. Потенциометрическому определению рН воды не мешают окраска, присутствие окислителей или восстановителей, взвешенных частиц, солей в повышенных концентрациях.
Аппаратура и реактивы
рН-метр-милливольтметр рН-121 (или другой марки).
Стеклянный электрод с водородной функцией ЭСЛ-43-07, ЭСЛ-63-07.
Xлорсеребряный электрод сравнения типа ЭВЛ-1МЗ.
Стакан вместимостью 50 или 100см3.
Стандартные буферные растворы с различным значением рН:
Буферный раствор рН при температуре
298 К 293 К
1. 0,05 М раствор тетраоксалата калия 1,68 1,68
2. Насыщенный при 25 °С раствор
гидротартрата калия 3,56 -
3. 0,05 М раствор гидрофталата калия 4,01 4,00
4. 0,025 М раствор фосфата калия
однозамещенного и 0,025 М раствор фосфата
натрия двузамещенного 6,86 6,88
5. 0,01 М раствор тетрабората натрия 9,18 9,22
Требования техники безопасности. Перед выполнением лабораторной работы студенты должны получить инструктаж у преподавателя по технике безопасности при проведении химических анализов. Каждый студент должен расписаться в журнале по технике безопасности.
Выполнение работы. Перед началом работы стеклянный электрод выдерживают в воде или в слабом растворе кислоты.
Настройку прибора по буферным растворам проводят в следующем порядке: наливают в стакан один из буферных растворов (например, с рН = 4,01), опускают в него электроды, подключают электроды к прибору. Включают прибор на соответствующий диапазон измерения рН. Установив указатель температурного корректора на соответствующую температуру, настраивают прибор на значение рН данного буферного раствора (в рН-121 — ручкой резистора «Калибровка»). Проверяют настройку прибора по другим буферным растворам. При отклонении показания прибора от значения рН раствора более чем на ±0,5 рН (в диапазоне 1 — 14), или на 0,05 (в диапазонах I —4, 4 — 9, 9— 14) необходимо провести корректировку ручкой резистора «Крутизна».
При каждом погружении электродов в буферный раствор электроды тщательно промывают дистиллированной водой, удаляют избыток воды с них фильтровальной бумагой. Отсчет рН по шкале прибора берут через 0,5—1 мин.
В стакан наливают пробу воды, в которой требуется определить рН. Электроды промывают дистиллированной водой, избыток воды удаляют фильтровальной бумагой. Погружают электроды в исследуемый раствор и измеряют рН.
Рассчитывают концентрацию водородных и гидроксидных ионов (в моль/л).
