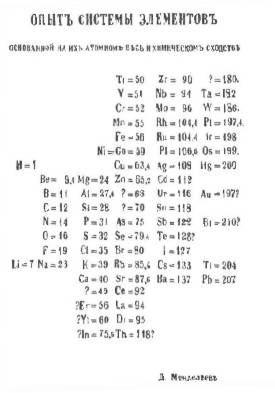- •«Далеко простирает химия руки свои на дела и мысли человеческие» (д.И. Менделеев.)
- •Состоит из одного или нескольких химических элементов.
- •Вопрос: Что мы знаем об атомах?
- •1930-Е годы - известно 92 элемента (до урана).
- •Что это значит?
- •Новые подходы к синтезу новых материалов
- •Вопрос: Как предсказать, какими свойствами обладает данный материал?
- •Спасибо, что ознакомились с еще одной интересной темой.
8 КСЕ Концептуальные уровни химических систем
или
Чем определяются свойства материалов?
|
|
|
|
Структура материалов может быть весьма различной
Долгое время считалось, что свойства материалов определяются, главным образом, частицами (атомами), из которых состоят тела.
Но затем стало ясно, что хотя вода и лед состоят из одних элементов, свойства их очень различаются, и это связано с тем, как эти отдельные атомы расположены в пространстве.
Было введено понятие о трех агрегатных состояниях вещества:
газообразное,
жидкое,
твердое.
Но затем стало ясно, что необходимо знать и "способ приготвления" материала.
Пример: дамасская сталь, способ изготовления которой был утерян;
железная колонна в Дели, которая стоит уже сотни лет и не ржавеет: современные технологии - "металлическое стекло" (аморфная сталь).
Сегодня ученые обращают внимание на необычные свойства материалов, полученных природой.
Пример: очень крепкие нити паутины (аналог – полиарамидные волокна);
красивые минерала –драгоценные камни (аналог – фианиты);
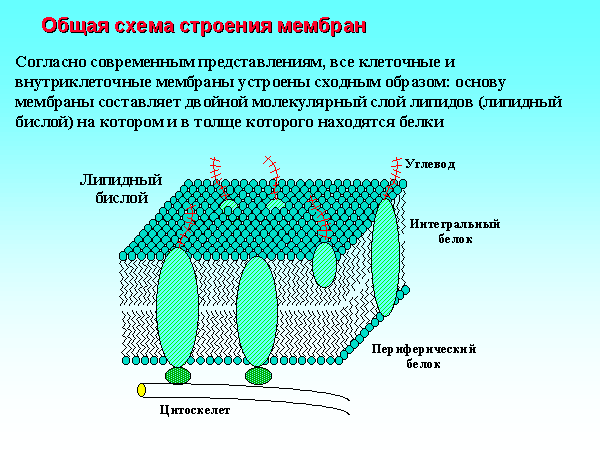
биологические мембраны - (аналог ионообменные мембраны).
|
|
Биологические мембраны |
Ионообменные мембраны |
|
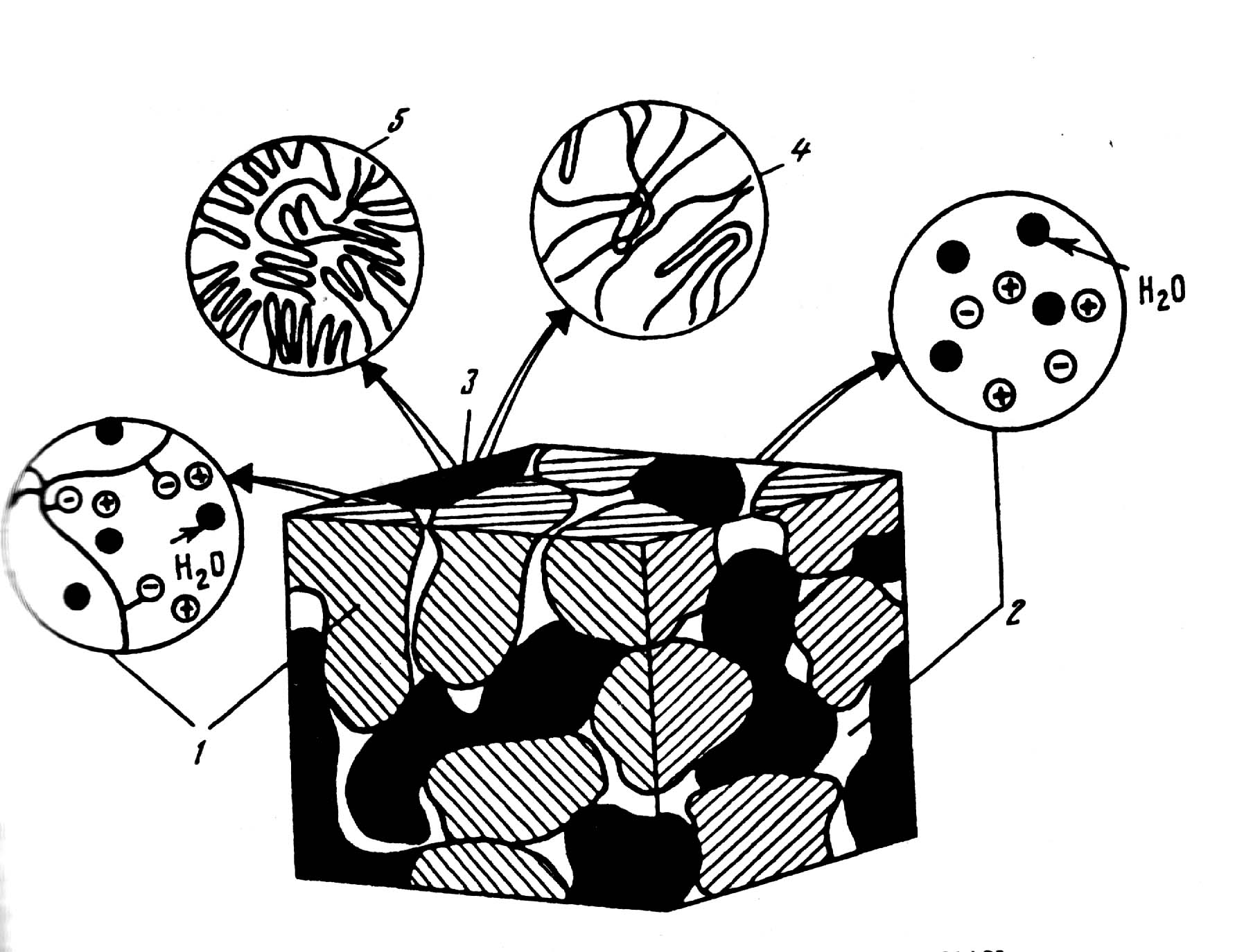
Схематичное строение многофазной структуры ионита:
гидрофобные участки (скопление полимерных цепей без фиксированных групп 4 и или инертное связующее 5) |
Все нанотехнологии основываются на такого рода материалах, а также на тех из них, которые в природе отсутствуют.
Эти материалы синтезируют, изучают и производят химики.
«Далеко простирает химия руки свои на дела и мысли человеческие» (д.И. Менделеев.)
Химия пытается раскрыть эти тайны.
Химия – это наука о химических элементах, их соединениях и химических превращениях, возникающих в результате химических реакций.
Материал – обладает некоторыми общими свойствами, по которым его можно распознать. Изменение свойств, отличающих один материал от другого, обычно невелико. Химический состав материала тоже может быть непостоянным, но его изменения обычно незначительны (дерево, пластик, кожа).
Состоит из одного или нескольких веществ.
|
|
|
Общий вид и типы древесины |
||
Вещество – обладает совокупностью свойств, по которым его можно распознать. Эти свойства постоянны для всех образцов вещества (поваренная соль, полиэтилен).
Состоит из одного или нескольких химических элементов.
|
|
Гранулированный полиэтилен |
|
Молекула – наименьшая частица вещества, обладающая всеми свойствами этого вещества.
Химический элемент – вещество, все атомы которого имеют одинаковый положительный заряд ядра; мельчайшая частица простого вещества, которая не поддается дальнейшему разложению с помощью химических реакций (кислород, кремний, платина).
|
|
Чистое железо |
Железная колонна в Дели |
Химический элемент по-разному проявляет себя в различных соединениях: Пример:
водород H2, - газ, HCl- соляная кислота, H2O - вода.
Вопрос: Что мы знаем об атомах?
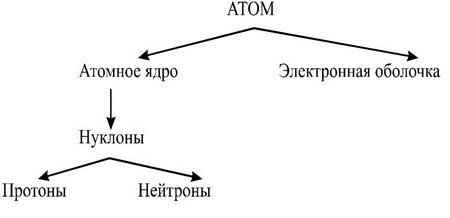

Изотопы
– разновидности
химических элементов, имеющие одинаковый
заряд Z,
но различающиеся
по массе ядра (они
имеют разное количество нейтронов N).
Изотопы
имеют одинаковое строение электронных
оболочек, т.е. очень
близкие химические свойства.
Физические
свойства
(стабильность, поведение в электрическом
поле, подвижность) могут
отличаться.
Наиболее сильно они отличаются у
водорода![]() ,
дейтерия
,
дейтерия
![]() ,
трития
,
трития
![]() .
.
Распространенность изотопов неодинакова. Наиболее много – устойчивых изотопов с четным атомным числом.
Изотопы урана |
Протоны |
Нейтроны |
В земной коре, % |
U92234 |
92 |
132 |
0.0057 |
U92238 |
92 |
146 |
99.27 |
U92235 |
92 |
143 |
0.72 |
1930-Е годы - известно 92 элемента (до урана).
Середина 1990 годов - открыто 109 элементов (были открыты тяжелые трансурановые элементы, которые живут очень короткое время. Названия этим элементам даются в честь великих ученых: 102 элемент - нобелий, 103 - лоуренсий, 104 - курчатовий, 105 - жолиотий, 106 - резерфордий, 107 - борий, 108 - ганий, 109 - мейтнерий).
В 1999г. - открытие 114 элемента. На сегодня известно 118 элементов.
Вопрос: Зачем нужно знать свойства элементов, и как разобраться во всем их многообразии?
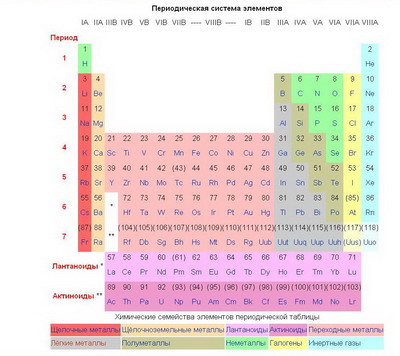
Атомы можно упорядочить, например, как это показано ниже.
Водород Z=1, 1 электрон, незаполненная электронная оболочка, газ;
Гелий Z=2, 2 электрона, заполненная оболочка, инертный газ; Литий Z=3, 3 электрона, из них 2 электрона на первой оболочке, 1 электрон на второй (внешней) оболочке, активный металл; и т.д.
|
Но в 1869 году гений Менделеева позволил расположить 62 известных элемента в виде периодической таблицы. Периодическая система элементов отражает периодическую зависимость физических и химических свойств элементов от их атомного веса (в современной формулировке – от заряда атомных ядер элементов, равного атомному номеру). |
Пример: элементы с порядковыми номерами z= 2, 10, 18, 36, 54 и 86 (разности атомных номеров 8,8,18,18,18) обладают сходными свойствами и являются инертными газами.
В 80-е годы 19 века таблица получила широкое распространение после того, как были открыты некоторые элементы, для которых Менделеев оставил пустые клетки в своей таблице.
Периодическая система в своем первом варианте просто отражала существующее положение дел. Как и в случае с кеплеровскими законами движения планет, таблица никак не объясняла, почему это должно быть именно так.
Только с появлением квантовой механики и, в особенности, принципа запрета Паули* стал понятен истинный смысл расположения элементов в периодической таблице.
|
Все известные химические элементы образуют 8 вертикальных столбцов - групп, обозначаемых вверху римскими цифрами, причем все группы содержат 2 подгруппы. Номер группы в П.с. соответствует высшей положительной валентности элемента. Свойства элементов в группах и подгруппах с ростом их атомного номера изменяются закономерно Пример: в группе 1а повышается химическая активность Me Горизонтальные ряды П.с. называют периодами и обозначают арабскими цифрами. Внутри каждого периода наблюдается более или менее равномерный переход от активных металлов к неметаллам и инертным газам. |
*Принцип Паули запрещает существование в атоме электронов в одинаковом квантовом состоянии.
Состояние электрона в атоме определяется 4 квантовыми числами:
главным квантовым числом n=1, 2, 3…;
орбитальным квантовым числом l=0,1,…, n-1;
магнитным квантовым числом ml=0, 1, 2, l;
спиновым квантовым числом ms 1/2.
Каждому значению l соответствует (2l+1) значений ml,
а каждому значению ml два возможных значения ms.