
- •Глава 8 методы генной инженерии. Промышленный синтез белков, инсулина, соматотропина и интерферона
- •8.1. История создания генетической инженерии
- •8.2. Схема строения молекулы днк и триплетность генетического кода
- •Модель днк
- •8.3. Ферменты в генной инженерии
- •8. 4. Технология получения рекомбинантной молекулы днк
- •Рекомбинантной молекулы днк
- •8. 5. Векторы, используемые для клонирования днк
- •8. 6. Экспрессия генов в бактериальных клетках и микроорганизмах
- •До копирования всего структурного гена
- •С большой рибосомной субъединицей
- •В качестве объекта для клонирования и экспрессии
- •8.7. Метод электрофорезного разделения днк и этапы идентификации днк по Саузерну
- •Для электрофореза днк в агаровом геле
- •Идентификации днк методом Саузерн-блот гибридизации
- •8. 8. Секвенирование днк и получение генов
- •Семейства меченных фрагментов днк
- •Полученной методом секвенирования днк
- •Днк ферментативным методом
- •8. 9. Амплификация (увеличение числа копий) фрагментов днк с помощью метода полимеразной цепной реакции (пцр)
- •Фрагмента днк
- •8.10. Генетическая инженерия и ее возможности для практики
- •8. 11. Промышленный синтез белков
- •«Расплодки»
- •8. 12. Биотехнология получения инсулина, гормона роста и интерферона
- •При синтезе интерферона человека в e. Coli.
- •Глава 9
- •9. 2. Трансгенные животные (метод получения)
- •9. 2. 1. Методы введения чужеродного гена в организм животного
- •9.2.2. Создание разных видов трансгенных животных
- •9. 2. 3. Клонирование
- •В яйцеклетку (по Беквисту)
- •Методом пересадки ядер
- •9. 2. 4. Межвидовые пересадки эмбрионов и получение химерных животных
- •9. 2. 5. Получение гомозиготных диплоидных потомков
- •Диплоидных потомков
- •9. 2. 6. Создание партеногенетических животных
- •9. 2. 7. О генетическом риске и биобезопасности в биоинженерии и трансгенных технологиях
- •9. 3. Государственное регулирование безопасности генно-инженерной деятельности в Республике Беларусь
- •Глава 10 иммобилизованные ферменты
- •10. 1. Понятие «инженерная энзимология»
- •И иммобилизация ферментов
- •И Saccharomyces carlsberqensis, используемые для получения фермента инвертазы
- •10.2. Механизм биотехнологического действия ферментов
- •10. 3. Технология глубинного культивирования микроорганизмов – продуцентов ферментов.
- •10. 4. Технология выделения и очистки ферментных препаратов
- •10. 5. Иммобилизованные ферменты. Методы иммобилизации
- •10. 6. Практическое применение иммобилизованных ферментов
- •При растворении тромбов в кровеносных сосудах
- •«Искусственная почка»
- •Глава 11
- •Гидроксилирование кортизола
- •11. 2. Методы контроля репродуктивной функции у животных
- •11. 3. Нейро-гуморальная регуляция внутрияичниковых процессов. Рост и развитие эмбрионов
- •Внутрияичниковых процессов
- •11. 4. Биотехнология получения потомков животных желаемого пола
- •Быков производителей по полу
- •Глава 12 получение аминокислот и белка одноклеточных организмов
- •12.1. Содержание незаменимых аминокислот в белках некоторых микроорганизмов
- •12. 2. Выращивание кормовых дрожжей
- •12.3. Белковые концентраты из бактерий
- •На газообразных углеводородах
- •12.4. Кормовые белки из водорослей
- •12. 5. Белки микроскопических грибов
- •12. 6. Кормовые белковые концентраты из растений
- •12. 7. Производство незаменимых аминокислот
- •Из аспарагиновой кислоты
- •12. 8. Производство кормовых витаминных препаратов
- •12. 9. Кормовые липиды
- •12. 10. Производство ферментных препаратов
- •Глава 13
- •13. 2. Результаты использования пребиотиков
- •13. 3. Эффективность использования гербиотиков и симбиотиков
- •13. 4. Результаты применение заквасок для силосования
- •Заключение
- •Литература Основная
- •Дополнительная
- •Содержание
До копирования всего структурного гена
Информация о генах, кодирующих белки (структурных генах), расшифровывается в ходе двух последовательных процессов:
-синтеза РНК (транскрипция);
- синтеза белка (трансляция).
Эти процессы обеспечивают правильный перевод зашифрованной в ДНК генетической информации с языка нуклеотидов на язык аминокислот. Последовательность аминокислот в белке задает его структуру и функцию. Когда у клетки возникает потребность в каком-то белке, то включается транскрипция соответствующего структурного гена, а когда такая потребность исчезает, транскрипция выключается.
Транскрипция начинается со связывания РНК–полимеразы с промотором. Далее последовательно копируется весь структурный ген (кодирующая область) – от первого нуклеотида до последнего – с образованием матричной РНК (м-РНК; рис. 8.14; 1).
У эукарио, в большинстве структурных генов кодирующие области (экзоны) чередуются с некодирующими областями (интронами; Рис. 8.14; 2).
Экзон – это кодирующая (несущая информацию) область гена (Рис. 8.14;3).
В клетке первичная РНК подвергается модификации, в результате которой участки, соответствующие интронам, вырезаются с помощью ферментов (Рис. 8.14; 4).
Экзонные последовательности сшиваются друг с другом «торец» в «торец» (сплайсинг) с образованием функциональной мРНК. Этот процесс называется сплайсингом или процессингом РНК (Рис. 8.14;5).
Трансляция – это синтез белков на матричной РНК (м-РНК); он происходит при участии транспортной РНК (т-РНК), ферментов и различных белковых факторов.
Экспрессия структурных генов осуществляется под строгим контролем регуляторных систем, запускающих транскрипцию только в том случае, когда возникает потребность в определенном белке.
Трансляция.
Трансляция начинается со связывания м-РНК с малой рибосомной субъединицей. Затем происходит комплементарное спаривание первого кодона м-РНК с антикодоном инициаторной транспортной РНК, несущей метионин. К образовавшемуся комплексу присоединяется большая рибосомная субъединица и образуется комплекс инициации, готовый к синтезу полипептидной цепи (рис. 8.15).
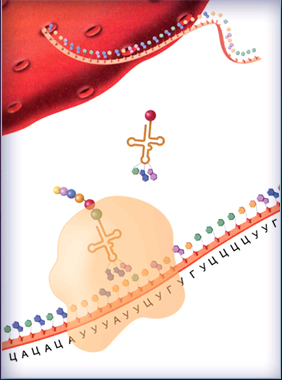
Рис. 8.15. Комплекс инициации
С большой рибосомной субъединицей
После образования инициаторного комплекса активируется следующий кодон матричной РНК. Он спаривается с антикодоном транспортной РНК, несущей соответствующую аминокислоту, закодированную в триплете.
Первая аминокислота в полипептидной цепи, метионин, соединяется со следующей с помощью пептидной связи и отщепляется от транспортной РНК.
Свободная транспортная РНК покидает рибосому. Рибосомный комплекс перемещается вдоль молекулы матричной РНК, и комплекс транспортной РНК с присоединенными аминокислотами занимает освобожденное место.
Следующий конец матричной РНК становится активированным и спаривается с соответствующим антикодоном транспортной РНК, несущим следующую аминокислоту. Эти события повторяются до тех пор, пока рибосома не дойдет до конца (рис. 8.16).
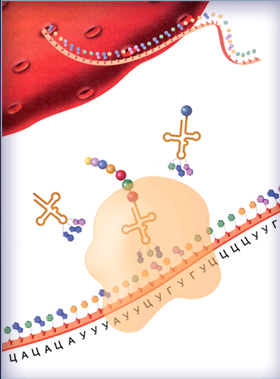
Рис. 8.16. Конечная точка прохождения рибосомы
Введение генов в бактерию и их экспрессия.
Для введения генов в бактерии фрагменты геномной ДНК изменяют, удаляя из них некодирующие области и участки соседних генов, в следующей последовательности:
1. Для введения генов в клетки прокариот подбирают соответствующий вектор, способный проникнуть в клетку реципиента. Чаще всего используют ДНК–фаг или плазмиду бактерий.
2. Плазмиду разрезают рестриктазой для образования «липких концов».
3. При необходимости производят надстройку концов ДНК у вектора, чтобы они были комплементарны концам ДНК вводимого гена.
4. ДНК донора разрушают рестриктазами для выделения генов.
5. Для введения генов в бактерии фрагменты геномной ДНК изменяют, удаляя из них некодирующие области и участки соседних генов.
6. При объединении в одном растворе ДНК вводимого гена и ДНК вектора, комплементарные концы «слипаются» и образуются водородные связи. С помощью ДНК-лигазы сшивают цепи гибридной ДНК.
7. Образованная гибридная молекула вводится в клетку бактерии-реципиента.
8. У прокариот структурный ген представляет собой непрерывный участок молекулы ДНК, а включение и выключение транскрипции обеспечивается дополнительными факторами транскрипции, которые связываются с соответствующими участками ДНК.
В бактериальной клетке содержится 2-3 тысячи различных белков, каждая из форм которых составляет в среднем 0,04% от их общей массы. При клонировании и экспрессии в бактериях чужеродного гена доля кодируемого им индивидуального белка может достигать 40%. Клетки, в которых эта величина составляет 2% и более, называется суперпродуцентами. В целях создания оптимальных условий для наращивания культуры и синтеза в ней высоких концентраций белков, экспрессию клонируемых генов у бактерий продуцентов включают только на поздних стадиях их развития.
Экспрессия генов в дрожжах.
Дрожжевые клетки удобно использовать для получения разнообразных продуктов промышленного назначения. Преимуществами дрожжей, по сравнению с бактериями, является их рост на дешёвых субстратах и высокая генетическая стабильность при промышленном культивировании. Экспериментировать с дрожжевыми клетками легко, так как они имеют сравнительно малый размер генома и короткое время регенерации (несколько часов). В качестве объекта для клонирования и экспрессии рекомбинантных ДНК чаще всего используют Saccharomyces cerevisiae (рис. 8.17; 1 –экспрессирование; 2 - клонирование).
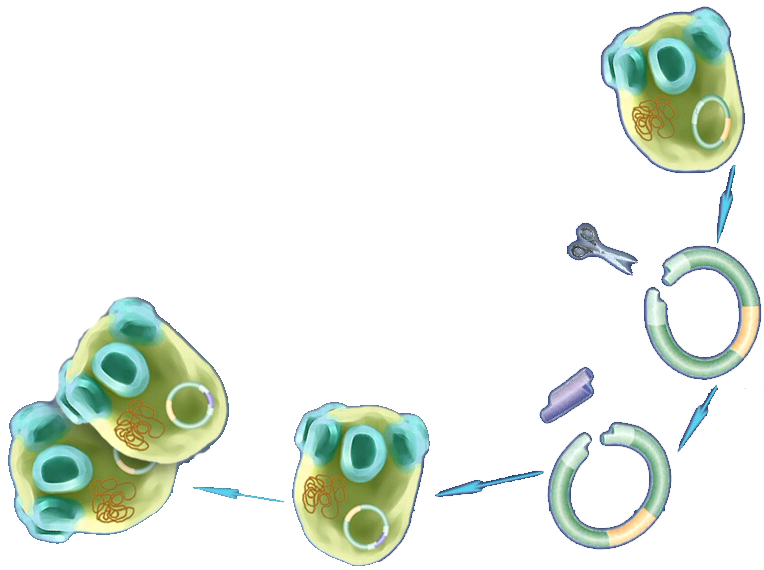
2
1
Рис. 8.17. Схема применения Saccharomyces cerevisiae
