
- •Глава 8 методы генной инженерии. Промышленный синтез белков, инсулина, соматотропина и интерферона
- •8.1. История создания генетической инженерии
- •8.2. Схема строения молекулы днк и триплетность генетического кода
- •Модель днк
- •8.3. Ферменты в генной инженерии
- •8. 4. Технология получения рекомбинантной молекулы днк
- •Рекомбинантной молекулы днк
- •8. 5. Векторы, используемые для клонирования днк
- •8. 6. Экспрессия генов в бактериальных клетках и микроорганизмах
- •До копирования всего структурного гена
- •С большой рибосомной субъединицей
- •В качестве объекта для клонирования и экспрессии
- •8.7. Метод электрофорезного разделения днк и этапы идентификации днк по Саузерну
- •Для электрофореза днк в агаровом геле
- •Идентификации днк методом Саузерн-блот гибридизации
- •8. 8. Секвенирование днк и получение генов
- •Семейства меченных фрагментов днк
- •Полученной методом секвенирования днк
- •Днк ферментативным методом
- •8. 9. Амплификация (увеличение числа копий) фрагментов днк с помощью метода полимеразной цепной реакции (пцр)
- •Фрагмента днк
- •8.10. Генетическая инженерия и ее возможности для практики
- •8. 11. Промышленный синтез белков
- •«Расплодки»
- •8. 12. Биотехнология получения инсулина, гормона роста и интерферона
- •При синтезе интерферона человека в e. Coli.
- •Глава 9
- •9. 2. Трансгенные животные (метод получения)
- •9. 2. 1. Методы введения чужеродного гена в организм животного
- •9.2.2. Создание разных видов трансгенных животных
- •9. 2. 3. Клонирование
- •В яйцеклетку (по Беквисту)
- •Методом пересадки ядер
- •9. 2. 4. Межвидовые пересадки эмбрионов и получение химерных животных
- •9. 2. 5. Получение гомозиготных диплоидных потомков
- •Диплоидных потомков
- •9. 2. 6. Создание партеногенетических животных
- •9. 2. 7. О генетическом риске и биобезопасности в биоинженерии и трансгенных технологиях
- •9. 3. Государственное регулирование безопасности генно-инженерной деятельности в Республике Беларусь
- •Глава 10 иммобилизованные ферменты
- •10. 1. Понятие «инженерная энзимология»
- •И иммобилизация ферментов
- •И Saccharomyces carlsberqensis, используемые для получения фермента инвертазы
- •10.2. Механизм биотехнологического действия ферментов
- •10. 3. Технология глубинного культивирования микроорганизмов – продуцентов ферментов.
- •10. 4. Технология выделения и очистки ферментных препаратов
- •10. 5. Иммобилизованные ферменты. Методы иммобилизации
- •10. 6. Практическое применение иммобилизованных ферментов
- •При растворении тромбов в кровеносных сосудах
- •«Искусственная почка»
- •Глава 11
- •Гидроксилирование кортизола
- •11. 2. Методы контроля репродуктивной функции у животных
- •11. 3. Нейро-гуморальная регуляция внутрияичниковых процессов. Рост и развитие эмбрионов
- •Внутрияичниковых процессов
- •11. 4. Биотехнология получения потомков животных желаемого пола
- •Быков производителей по полу
- •Глава 12 получение аминокислот и белка одноклеточных организмов
- •12.1. Содержание незаменимых аминокислот в белках некоторых микроорганизмов
- •12. 2. Выращивание кормовых дрожжей
- •12.3. Белковые концентраты из бактерий
- •На газообразных углеводородах
- •12.4. Кормовые белки из водорослей
- •12. 5. Белки микроскопических грибов
- •12. 6. Кормовые белковые концентраты из растений
- •12. 7. Производство незаменимых аминокислот
- •Из аспарагиновой кислоты
- •12. 8. Производство кормовых витаминных препаратов
- •12. 9. Кормовые липиды
- •12. 10. Производство ферментных препаратов
- •Глава 13
- •13. 2. Результаты использования пребиотиков
- •13. 3. Эффективность использования гербиотиков и симбиотиков
- •13. 4. Результаты применение заквасок для силосования
- •Заключение
- •Литература Основная
- •Дополнительная
- •Содержание
8. 4. Технология получения рекомбинантной молекулы днк
Основные элементы технологии:
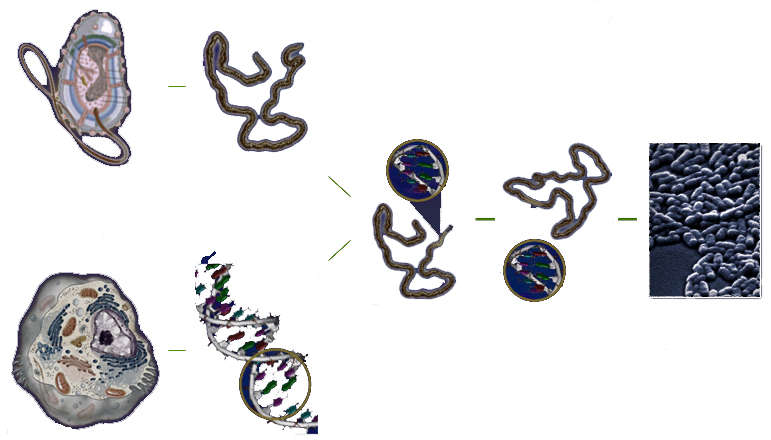
1. Для внедрения какого либо гена в клетку – реципиент (принимающую клетку) используют небольшую молекулу ДНК, которая обладает способностью проникать в эту клетку (рис. 8.9). Такую молекулу называют вектором. Чаще всего это молекула ДНК фага, вируса или плазмидная (1).
1 2
3 4 5 6 7
Рис. 8.9 Элементы технологии получения
Рекомбинантной молекулы днк
2. ДНК-вектор извлекают из клетки и разрезают (лианеризуют) в таком месте, куда можно будет встроить ген донора (2).
3. Из организма доноров нужных генов, выделяют молекулу донорной, или клонируемой, ДНК, которая содержит нужную последовательность генов (3).
4. Донорную ДНК гидролизуют ферментами в нужных местах, вырезая участок с необходимым геном и отделяя его от других частей молекулы ДНК – донора (4).
5. ДНК-вектор «сшивают» (соединяют) с вводимым геном донора. Образуется рекомбинантная ДНК (5).
6. Новая молекула ДНК, содержащая встроенный ген, вводится в клетку хозяин (реципиент). Для этого используют специальные приёмы: прогревание, добавление некоторых веществ и др.(6).
7. В клетке-хозяине рекомбинантная ДНК реплицируется (воспроизводится) и передаётся потомкам (7).
Введение рекомбинантной ДНК в клетку-хозяин называется трансформацией. Организмы, содержащие фрагменты чужеродной ДНК, называют трансгенными.
8. 5. Векторы, используемые для клонирования днк
Основным изобретением, применяемым для доставки чужеродных генов в различные организмы являются векторы. Вектор – это молекула ДНК, способная самостоятельно реплицироваться в клетках различных организмов и обеспечивать размножение (клонирование) и работу (экспрессию) встроенного в неё искусственно какого-либо гена. В английской литературе вектор принято обозначать словом vehicle, т. е. повозка.
Объединение разных генов в молекуле ДНК бесполезно, если вновь образованные рекомбинантные ДНК не будут реплицироваться в клетке-хозяине. Таким образом, если одна часть рекомбинантной молекулы ДНК несет нужный ген, который предполагается клонировать, то другая должна содержать информацию, для репликации в клетке рекомбинантной ДНК. Чтобы решить эту проблему, используют клонирующие векторы («вектор» от латинского vector - переносчик).
Клонирующие векторы должны иметь малый размер, хорошую проницаемость в клеточной мембране, способность размножаться в клетке реципиента, а также иметь такую область в молекуле ДНК, в которую можно встроить фрагмент чужеродной молекулы ДНК.
Плазмиды – небольшие внехромосомные кольцевые молекулы ДНК. Часто в плазмидах содержатся гены деградации ксенобиотиков, устойчивости к антибиотикам. У растений часто применяется Ti-плазмида Agrobakterium tumefaciens.
Наиболее распространёнными векторными молекулами, созданными самой природой, являются плазмиды, представляющие собой небольшие кольцевые молекулы ДНК, самостоятельно живущие в цитоплазме бактерий. Они способны к автономной репликации, обладают генами устойчивости к антибиотикам, что позволяет легко обнаружить их присутствие в клетках. Плазмиды могут внедряться в хромосому клетки хозяина, а также имеют участки ДНК (сайты рестрикции) для действия ряда рестриктаз, т. е. каждая такая рестриктаза может разрезать кольцо плазмидной ДНК и переводить её в линейное состояние. После этого линейную плазмиду можно легко соединить с фраг-
ментом ДНК другого вида с подходящими липкими концами.
Работа по использованию векторов началась с кольцевой плазмиды pSC101. Она несёт только один участок расщепления (сайт рестрикции) рестриктазой EcoRl и превращается под действием этого фермента из кольцевой в линейную молекулу, концы которой могут «слипаться» между собой или с любыми фрагментами другой ДНК, полученными под действием той же рестриктазы. Кроме того, она несёт ген устойчивости к антибиотику тетрациклину, а значит, легко обнаруживается в бактериях, если их растить в среде с этим антибиотиком. Эти свойства pSC101и были использованы для создания и клонирования первых гибридных (рекомбинантных) ДНК, которые были функционально активными, т. е. могли бы стабильно существовать в клетке и наделять (трансформировать) её новыми признаками.
Примером введения фрагмента чужеродной ДНК в плазмидный вектор pSC101с помощью рестриктазы EcoRl схематически показаны на рис. 8.10.
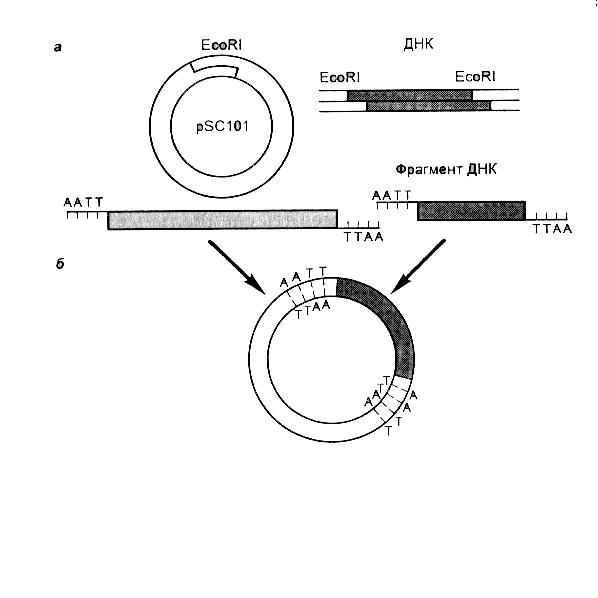
Риc. 8.10. Введение фрагмента рекомбинантной молекулы ДНК в плазмидный вектор pSC101 с помощью рестриктазы ЕсоRI, образующей “липкие концы”
В настоящее время наибольшее распространение получила плазмида pBR322, в связи с тем, что у неё оказалось больше участков, разрезаемых различными рестриктазами и, поэтому, с ней можно «сшивать» самые разные фрагменты ДНК.
Кроме того, у плазмиды pBR322 не один, а два маркера для селекции на бактериальных средах, поскольку помимо тетрациклина эта плазмида кодирует ещё устойчивость к ампициллину (рис. 8.11).
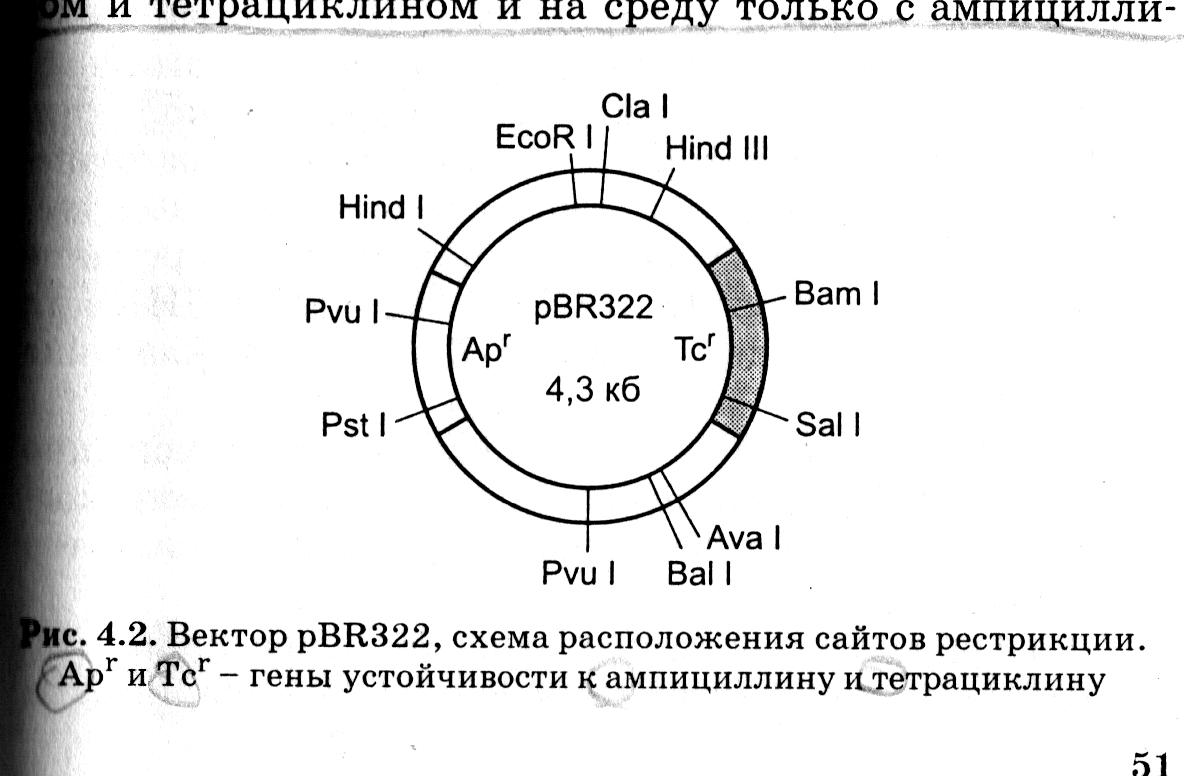
Рис. 8.11. Вектор pBR322.
Схема расположения сайтов рестрикции
В том случае, если один из этих генов (например, ген устойчивости к тетрациклину) разрезать определённой рестриктазой, то при встраивании в это место фрагмента чужеродной ДНК целостность гена нарушается и определяемый им признак исчезает. Это позволяет легко отбирать гибридные плазмиды, специальным образом введённые в бактериальные клетки кишечной палочки E. coli при помещении их в твёрдую питательную среду с антибиотиками ампициллином и тетрациклином и на среду только с ампициллином.
Трансформированные бактерии E. coli, т. е. содержащие гибридные плазмиды, растут на среде с ампициллином, но не растут в среде с двумя антибиотиками. Селективный рост позволяет отбирать и выращивать только клетки, содержащие гибридные молекулы ДНК.
Кроме плазмид в качестве векторов также успешно используют фаги и вирусы. В последнее время появились космиды – особый тип векторов, сочетающих свойства плазмиды и фага.
Сегодня уже получают тысячи химерных плазмид, каждая из которых содержит специфический фрагмент, например ДНК человека, мыши или дрозофилы. Посредством скрининга большого числа таких плазмид возможно исследовать весь геном любого из этих организмов.
Большие фрагменты хромосомной ДНК имеют размер около 15 кб: т.е. «килобаз». Это единица, используемая для выражения размера нуклеиновых кислот (1 кб = 1000 нуклеотидов). ДНК нестабильная в составе плазмид, становится весьма стабильной при встраивании её в специально сконструированные штаммы фага λ. ДНК этого фага сравнительно невелика, гены его хорошо изучены и размножается он в бактериальных клетках очень интенсивно.
При получении λ-векторов используется то обстоятельство, что вся центральная часть молекулы ДНК фага λ не нужна для репликации в E. coli, а функционирует только при интеграции фаговой ДНК в бактериальную хромосому. При этом были сконструированы специальные штаммы λ, в ДНК которых сайты для рестриктазы EcoRl расположены таким образом, что правый и левый концевые фрагменты фаговой ДНК, необходимые для репликации, остаются нетронутыми. После расщепления с помощью EcoRl эти концевые фрагменты благодаря их большим размерам легко отделить от всех остальных EcoRl – фрагментов. Затем использовать их для получения новых λ-подобных фагов, каждый из которых содержит левый и правый концевые фрагменты, а также вставку чужеродной ДНК размером около 15 кб. Удобным оказалось то обстаятельство, что для созревания фага λ его ДНК должно иметь длину около 45 кб, благодаря чему при конструировании химерных ДНК in vitro для последующего размножения отбираются только те из них, которые содержат оба конца фаговой ДНК и вставку чужеродной ДНК подходящего размера, т. е. около 15 кб.
