
- •Основная
- •Дополнительная
- •Методические указания, разработанные на кафедре и изданные в ризо бгу.
- •Вопросы по аналитической химии для подготовки к экзамену студентам биологического факультета.
- •Лекция Буферные растворы
- •Механизм действия буферной системы
- •РН некоторых биологических жидкостей.
- •Расчёт рН буферного раствора
- •Лекция Способы выражения концентрации растворов.
- •Домашние задания
- •Подготовка к второму занятию.
- •Подготовка к третьему занятию.
- •Подготовка к четвёртому занятию.
- •Принципы аналитической оптической спектроскопии.
- •Атомно – эмиссионная спектроскопия
- •Лекция 8 Атомно-абсорбционная спектроскопия
- •Способ атомизации.
- •Способы определения концентрации
- •Достоинства метода.
- •Недостатки метода.
- •Полярография
- •Качественный полярографический анализ
- •Количественный полярографический анализ
- •Амперометрия
- •Электрохимические методы анализа потенциометрия
- •Электроды сравнения и индикаторные электроды
- •Электроды сравнения
- •Индикаторные электроды.
- •Требования к индикаторным электродам.
- •Способы потенциометрического анализа Ионометрия, рН-метрия
- •Потенциометрическое титрование
- •Кулонометрический анализ (кулонометрия) Принципы метода.
- •Прямая кулонометрия
- •Кулонометрическое титрование
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
Кулонометрическое титрование
Сущность метода. При кулонометрическом титровании определяемое вещество X, находящееся в растворе в электрохимической ячейке, реагирует с «титрантом» Т – веществом, непрерывно образующемся (генерируемом) на генераторном электроде при электролизе вспомогательного вещества, также присутствующего в растворе. Окончание титрования – момент, когда всё определяемое вещество X полностью прореагирует с генерируемым «титрантом» Т фиксируют либо визуально индикаторным методом, вводя в раствор соответствующий индикатор, либо с помощью инструментальных методов – потенциометрически, амперометрически, фотометрически.
Таким образом, при кулонометрическом титровании титрант не прибавляется из бюретки в титрируемый раствор. Титрант не готовят и не стандартизируют. Роль титранта играет вещество Т, непрерывно генерируемое при электродной реакции на генераторном электроде.
Кулонометрическое титрование проводят при постоянном токе (гальваностатическом режиме) или в потенциостатическом режиме. Чаще кулонометрическое титрование проводят, поддерживая электрический ток постоянным в течение всего времени электролизе.
Вместо объёма прибавленного титранта в кулонометрическом титровании измеряют время τ и ток i электролиза. Процесс образования вещества Т в кулонометрической ячейке во время электролиза называется генерация титранта.
Кулонометрическое титрование при постоянном токе. При кулонометрическом титровании при постоянном токе измеряют время τ, в течение которого проводится электролиз, затем рассчитывают количество электричества Q, израсходованное при электролизе по формуле (2), после чего находят массу определяемого вещества X по соотношению (1).
Индикация конца титрования.
При электрохимической индикации ТЭ в испытываемый раствор (в генераторный сосуд) помещают ещё пару электродов, входящих в дополнительную индикаторную электрическую цепь. Окончание титрования можно фиксировать с помощью дополнительной индикаторной электрической цепи потенциометрически (рН-метрически) или амперометрически.
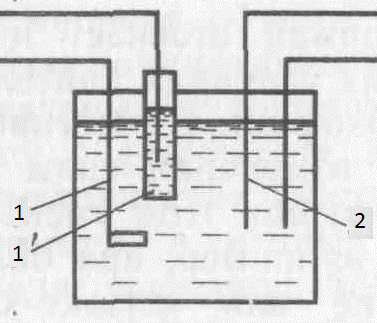
Рис.4. Электролитическая ячейка для кулонометрического титрования с внутренней генерацией титранта.
1 и 1’ – генераторные, 2 – индикаторные электроды.
Когда титрант генерируется в той же ячейке, где находится и определяемое вещество, кулонометрическое титрование называют титрованием с внутренней генерацией. Ячейки ч внешней генерацией титранта, когда титрант генерируется в отдельной камере и затем добовляется к анализируемому веществу, применяются реже, однако иногда они бываю крайне необходимы, например кулонометрическое определение кислот, основанное на генерирование гидроксильных ионов при электролизе воды. Для повышения электропроводности раствора вводят сильный электролит сульфат калия. На катоде происходит восстановлени6е воды
2H2O + 2e = H2 + 2OH-
а на аноде её окисление
2H2O = O2 +4H+ +4e
Чтобы не допустить случайного попадания ионов водорода из анодного пространства в рабочий объём применяются ячейки с внешней генерацией гидроксильных ионов.
