
- •Основная
- •Дополнительная
- •Методические указания, разработанные на кафедре и изданные в ризо бгу.
- •Вопросы по аналитической химии для подготовки к экзамену студентам биологического факультета.
- •Лекция Буферные растворы
- •Механизм действия буферной системы
- •РН некоторых биологических жидкостей.
- •Расчёт рН буферного раствора
- •Лекция Способы выражения концентрации растворов.
- •Домашние задания
- •Подготовка к второму занятию.
- •Подготовка к третьему занятию.
- •Подготовка к четвёртому занятию.
- •Принципы аналитической оптической спектроскопии.
- •Атомно – эмиссионная спектроскопия
- •Лекция 8 Атомно-абсорбционная спектроскопия
- •Способ атомизации.
- •Способы определения концентрации
- •Достоинства метода.
- •Недостатки метода.
- •Полярография
- •Качественный полярографический анализ
- •Количественный полярографический анализ
- •Амперометрия
- •Электрохимические методы анализа потенциометрия
- •Электроды сравнения и индикаторные электроды
- •Электроды сравнения
- •Индикаторные электроды.
- •Требования к индикаторным электродам.
- •Способы потенциометрического анализа Ионометрия, рН-метрия
- •Потенциометрическое титрование
- •Кулонометрический анализ (кулонометрия) Принципы метода.
- •Прямая кулонометрия
- •Кулонометрическое титрование
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
Прямая кулонометрия
Сущность метода. Прямую кулонометрию при постоянном токе применяют редко. Чаще используют кулонометрию при контролируемом постоянном потенциале рабочего электрода или прямую потенциостатическую кулонометрию.
В прямой потенциостатичекой кулонометрии электролизу подвергают непосредственно определяемое вещество. Измеряют количество электричества, затраченное на электролиз этого вещества, и по уравнению (1) рассчитывают массу m определяемого вещества.
В процессе электролиза потенциал рабочего электрода поддерживают постоянным, E = const, для чего обычно используют приборы – потенциостаты.
Постоянное значение потенциала E выбирают предварительно на основании рассмотрения вольт – амперной кривой, построенной в координатах ток i – потенциал E, полученной в тех же условиях, в которых будет проводиться электролиз. Обычно выбирают значение потенциала E, соответствующее области предельного тока для определяемого вещества.
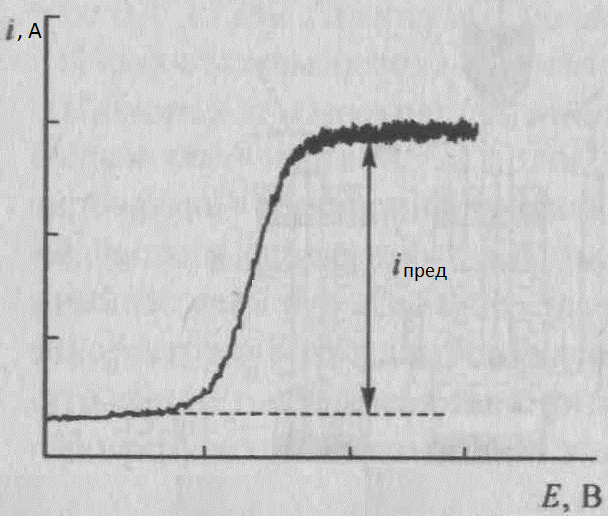
Рис1, Харитонов, стр. 468
По мере протекания процесса электролиза при постоянном потенциале электрический ток в ячейке уменьшается, так как понижается концентрация электроактивного вещества, участвующего в электродной реакции. При этом электрический ток уменьшается со временем по экспоненциальному закону от начального значения io в момент времени τ = 0 до значения i в момент времени τ
i = io ∙e-kτ, где k=const. (3)
График функции (3) схематично показан на рис. 2
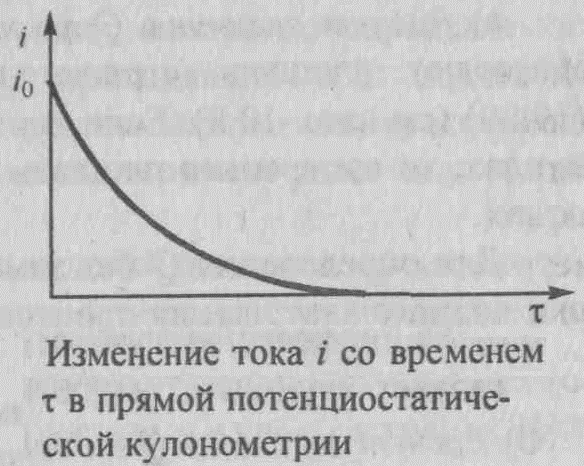
Рис.2 изменение тока i со временем τ в прямой потенциостатической кулонометрии.
Выход по току будет количественным, когда ток i уменьшится до нуля, т.е. при бесконечно большом времени τ. На практике электролиз определяемого вещества считают количественным, когда ток достигает очень малой величины, не превышающей ~0,1% от значения io.
Общее количество электричества Q, затраченное на электролиз определяемого вещества, равно
Q = ∫idτ, (4)
т.е. определяется площадью, ограниченной осями координат и экспонентой на рис.2
Для нахождения массы m прореагировавшего вещества требуется согласно (1) измерить или рассчитать количество электричества Q.
Способы определения количества электричества, прошедшего через раствор, в прямой потенциостатической кулонометрии. Величину Q можно определить расчётными способами либо с помощью химического кулонометра.
а) Расчёт величины Q по площади под кривой зависимости i от τ. Измеряют площадь, ограниченную осями координат и экспонентой (3) (см. рис. 2). Если ток i выражен в амперах, а время τ - в секундах, то измеренная площадь равна количеству электричества Q в кулонах.
б) Расчёт величины Q на основе зависимости In i от τ. В соответствии с (3) и (4) имеем:
формула, Харитонов, стр. 484, уравн.11 (5)
Таким образом, Q = io/k и для определения величины Q необходимо найти значения io и k.
Согласно (3) i = io e-kτ. После логарифмирования этого уравнения получим линейную зависимость In i от τ:
In i = In io – kτ (6)
Если измерить несколько значений i в различные моменты времени τ то можно построить график функции (6), схематически показанной на рис.3 и представляющий собой прямую линию.
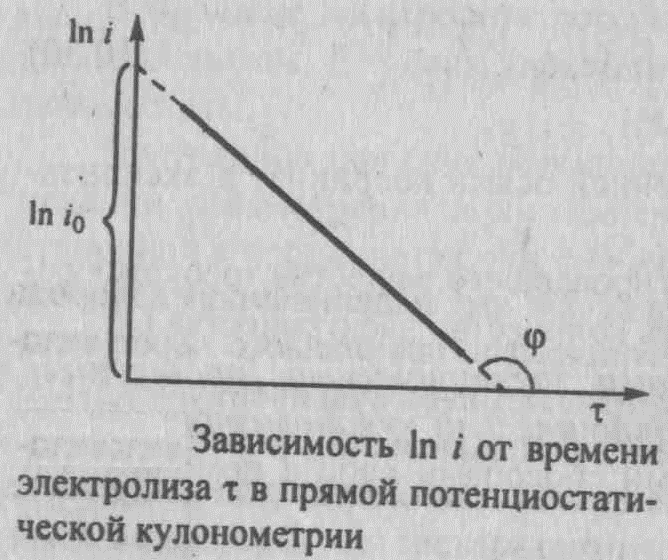
Рис.3. Зависимость In i от времени электролиза τ в прямой потенциостатической кулонометрии.
Отрезок, отсекаемой прямой линией на оси ординат In io, а тангенс угла φ наклона прямой к оси абсцисс равен tgφ = - k.
Зная значения k и In io , а следовательно, io, можно рассчитать величину Q = io/k, а затем и массу m по формуле (1).
в) Определение величины Q с помощью химического кулонометра. При этом способе в электрическую цепь кулонометрической установки включают химический кулонометр последовательно с электрохимической ячейкой, в которой проводят электролиза определяемого вещества. Количество электричества Q, проходящее через последовательно соединённые кулонометр и электрохимическую ячейку, одинаково. Конструкция кулонометра позволяет экспериментально определить величину Q ,
Чаще всего применяют серебряный, медный и газовые кулонометры, Использование серебряного и медного кулонометров основано на электрогравиметрическом определении массы серебра или меди, осаждающейся на платиновом катоде при электролизе. Зная массу металла, выделяющегося на катоде в кулонометре, можно рассчитать количество электричества Q.
Медный кулонометр содержит платиновые катод и анод, погружённые в сернокислый раствор соли меди (CuSО4). При электролизе на катоде выделяется металлическая медь:
Cu2+ + 2e = Cu
массу которой определяют, взвешивая платиновый катод до и после электролиза. Масса 0,3295 мг меди, осаждённой на платиновом катоде, отвечает затрате на электролиз 1 Кл электричества.
Кулонометры, особенно – серебряный и медный, позволяют определять количество электричества Q с высокой точностью, однако работа с ними довольно трудоёмка и продолжительна. Поэтому чаще применяют косвенную кулонометрию – кулонометрическое титрование.
