
- •Основная
- •Дополнительная
- •Методические указания, разработанные на кафедре и изданные в ризо бгу.
- •Вопросы по аналитической химии для подготовки к экзамену студентам биологического факультета.
- •Лекция Буферные растворы
- •Механизм действия буферной системы
- •РН некоторых биологических жидкостей.
- •Расчёт рН буферного раствора
- •Лекция Способы выражения концентрации растворов.
- •Домашние задания
- •Подготовка к второму занятию.
- •Подготовка к третьему занятию.
- •Подготовка к четвёртому занятию.
- •Принципы аналитической оптической спектроскопии.
- •Атомно – эмиссионная спектроскопия
- •Лекция 8 Атомно-абсорбционная спектроскопия
- •Способ атомизации.
- •Способы определения концентрации
- •Достоинства метода.
- •Недостатки метода.
- •Полярография
- •Качественный полярографический анализ
- •Количественный полярографический анализ
- •Амперометрия
- •Электрохимические методы анализа потенциометрия
- •Электроды сравнения и индикаторные электроды
- •Электроды сравнения
- •Индикаторные электроды.
- •Требования к индикаторным электродам.
- •Способы потенциометрического анализа Ионометрия, рН-метрия
- •Потенциометрическое титрование
- •Кулонометрический анализ (кулонометрия) Принципы метода.
- •Прямая кулонометрия
- •Кулонометрическое титрование
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
Способы потенциометрического анализа Ионометрия, рН-метрия
Способ определения концентрации ионов по измерению потенциала ионоселективного мембранного электрода называют ионометрией.
Приборы для прямой потенциометрии называют иономерами. Наиболее широкое применение нашла прямая потенциометрии для определения рН растворов с использованием стеклянного электрода. Потенциал стеклянного электрода описывается уравнением
E = k – 0,059рН
В качестве электрода сравнения используется хлорсеребряный электрод. Электроды помещают в анализируемый раствор и измеряют рН этого раствора с помощью прибора рН-метра.
При использовании других ионоселективных электродов готовят ряд растворов с известными концентрациями анализируемых ионов. Строят градуироваочный график зависимости потенциала индикатороного электрода от отрицательного десятичного логарифма к концентрации анализируемого иона. Измерив потенциал индикаторного электрода в растворе с неизвестной концентрацией, по градуировочному нрафику находят его концентрацию.
Потенциометрическое титрование
Зависимость потенциала индикаторного электрода от состава раствора используют для нахождения объёма в конечной точке титрования.
Объём титранта в конечной точке титрования находят разными способами. Строят кривую титрования в координатах: потенциал – объём титранта (интегральная кривая) и графически находят объём титранта в конечной точке титрования.
Слайд 9
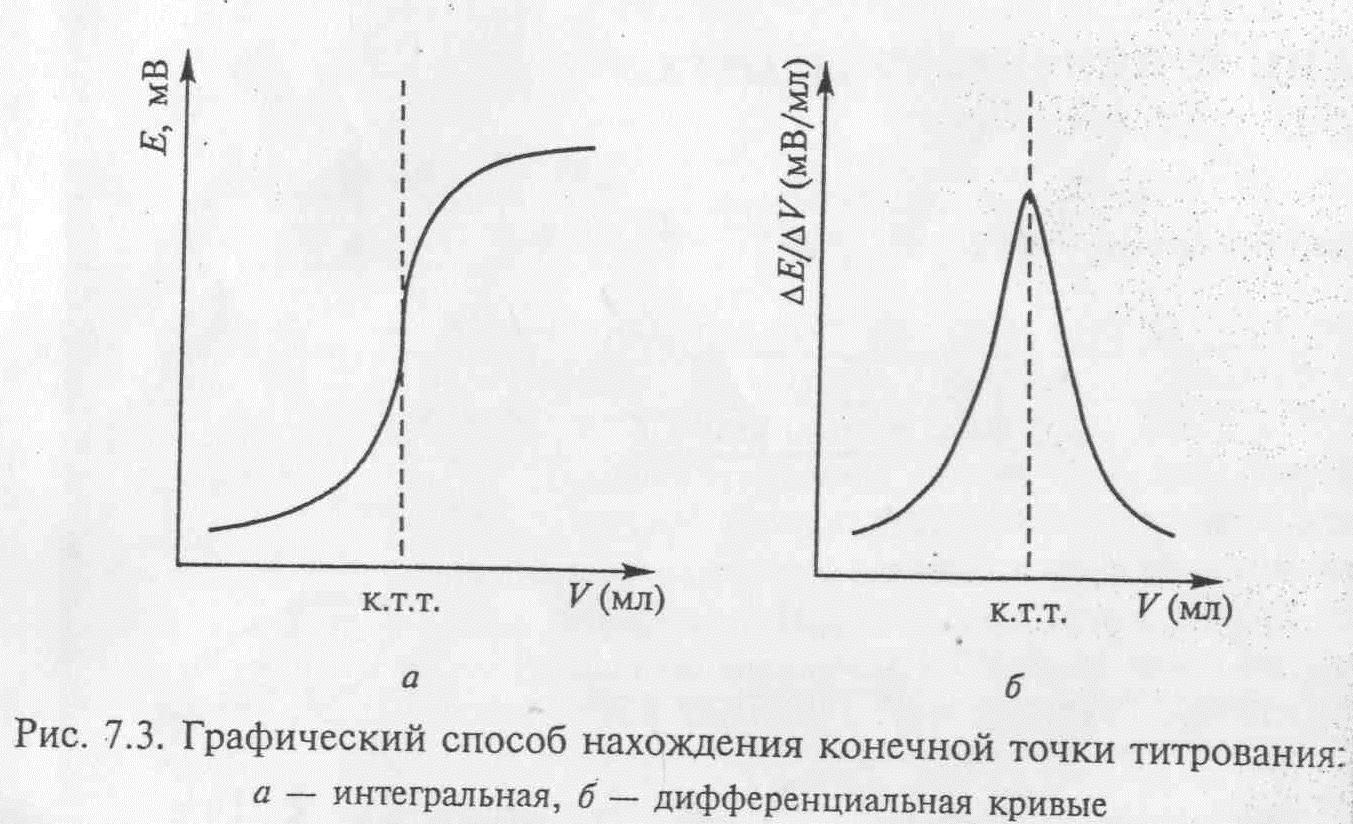
Другой способ состоит в построении дифференциальной кривой: на оси ординат откладывают отношение ∆E/∆V, а на оси абсцисс – объём прибавленного титранта V. Максимум на кривой титрования соответствует объёму титранта в конечной точке титрования.
Кулонометрический анализ (кулонометрия) Принципы метода.
Кулонометрический анализ (кулонометрия)основан на использовании зависимости между массой m вещества, прореагировавшего при электролизе в электрохимической ячейке, и количеством электричества Q, прошедшего через электрохимическую ячейку при электролизе только этого вещества. В соответствии с объединённым законом электролиза Фарадея масса m (в граммах) связана с количеством электричества Q (в кулонах) соотношением
m = QM/nF, (1)
где M – молярная масса вещества, прореагировавшего при электролизе, г/моль; n – число электронов, участвующих в электродной реакции; F – 96487 Кл/моль – число фарадея.
Количество электричества Q (в Кл), прошедшее при электролизе через электрохимическую ячейку, равно произведению электрического тока i (в А) на время электролиза τ (в с);
Q = iτ (2)
Если измерено количество электричества Q, то согласно (1)можно рассчитать массу m. Это справедливо в том случае, когда всё количество электричества Q, прошедшее при электролизе через электрохимическую ячейку, израсходовано только на электролиз данного вещества; побочные процессы должны быть исключены, т.е. выход по току должен быть равен 100%.
Главная задача кулонометрических измерений – как можно более точно определить количество электричества Q.
Кулонометрический анализ проводят либо в гальваностатическом режиме, т.е. при постоянном электрическом токе, либо при контролируемом постоянном потенциале рабочего электрода (потенциостатическая кулонометрия), когда электрический ток уменьшается в процессе электролиза.
В первом случае для определения количества электричества Q достаточно как можно более точно измерить время электролиза τ(с), постоянный ток i(А) и рассчитать величину Q по формуле (2).
Во втором случае величину Q определеяют либо расчётным способом, либо с помощью химических кулонометров.
Различают прямую кулонометрию и косвенную кулонометрию (кулонометрическое титрование).
