
- •Основная
- •Дополнительная
- •Методические указания, разработанные на кафедре и изданные в ризо бгу.
- •Вопросы по аналитической химии для подготовки к экзамену студентам биологического факультета.
- •Лекция Буферные растворы
- •Механизм действия буферной системы
- •РН некоторых биологических жидкостей.
- •Расчёт рН буферного раствора
- •Лекция Способы выражения концентрации растворов.
- •Домашние задания
- •Подготовка к второму занятию.
- •Подготовка к третьему занятию.
- •Подготовка к четвёртому занятию.
- •Принципы аналитической оптической спектроскопии.
- •Атомно – эмиссионная спектроскопия
- •Лекция 8 Атомно-абсорбционная спектроскопия
- •Способ атомизации.
- •Способы определения концентрации
- •Достоинства метода.
- •Недостатки метода.
- •Полярография
- •Качественный полярографический анализ
- •Количественный полярографический анализ
- •Амперометрия
- •Электрохимические методы анализа потенциометрия
- •Электроды сравнения и индикаторные электроды
- •Электроды сравнения
- •Индикаторные электроды.
- •Требования к индикаторным электродам.
- •Способы потенциометрического анализа Ионометрия, рН-метрия
- •Потенциометрическое титрование
- •Кулонометрический анализ (кулонометрия) Принципы метода.
- •Прямая кулонометрия
- •Кулонометрическое титрование
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
- •Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2.
Электрохимические методы анализа потенциометрия
Потенциометрический метод анализа относится к электрохимическим. Это метод определения концентрации ионов в растворе, основанный на измерении потенциала электрода, погруженного в исследуемый раствор. Потенциал отдельного электрода измерить невозможно. Необходимо составить соответствующую гальваническую ячейку. Она состоит из двух электродов, помещённых в анализируемый раствор. Потенциал одного из этих электродов – индикаторного – зависит от концентрации определяемого иона. Потенциал другого – электрода сравнения постоянен и не зависит от состава анализируемого раствора.
В аналитической практике используют две разновидности потенциометрического анализа. Первоая– прямая потенциометрия – измерение потенциала индикаторного электрода и нахождение концентрации определяемого иона по его величине. Вторая – потенциометрическое титрование - измерение потенциала индикаторного электрода в процессе титрования анализируемого раствора.
Электроды сравнения и индикаторные электроды
Слайд 1
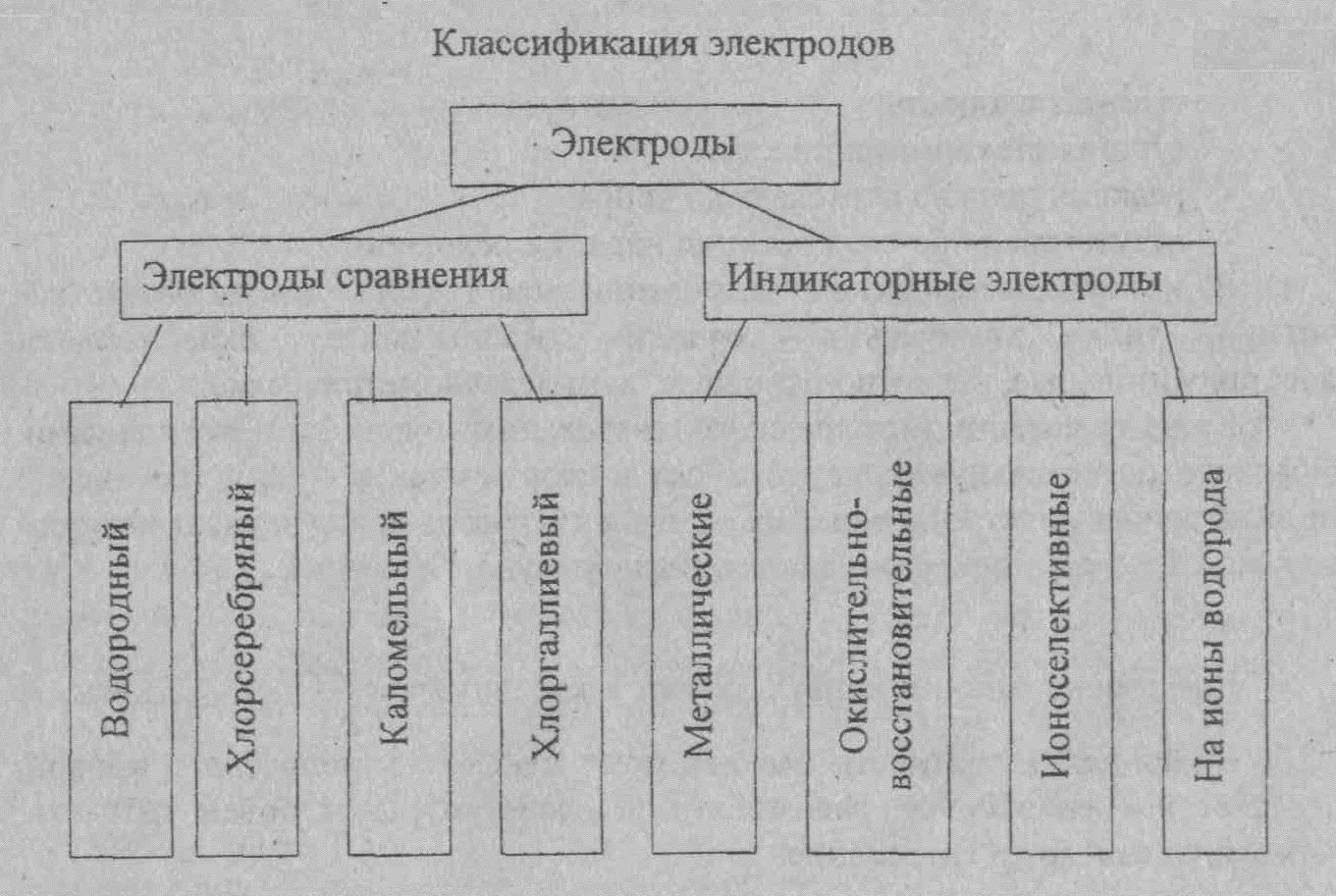
Электроды сравнения
Потенциал индикаторного электрода измеряют по отношению к электроду, потенциал которого сохраняется постоянным. Нормальный водородный электрод для практического использования не удобен. Поэтому в качестве электрода сравнения используют специально изготовляемые электроды, потенциалы которых остаются постоянными как при работе с ними, так и при их хранении. Наибольшее применение имеет хлорсеребряный электрод, изготовленный из серебряной проволоки, покрытой тонким слоем хлорида серебра, помещённый в раствор хлорида калия. Также используют каломельный электрод сравнения, содержащий металлическую ртуть, каломель (Hg2CI2) и хлорид калия. Это электроды второго рода. Потенциал электродов второго рода зависит от концентрации анионов.
Слайд 2
Хлорсеребряный электрод
Ag | AgCl | KCl
Каломельный электрод
Hg | Hg2Cl2 | KCl
Электрохимическая реакция – реакция на электроде
AgCl + e → Ag0 + Cl-
Потенциал хлорсеребряного электрода равен
Слайд 3

aAgCl = 1
aAg = 1

Если такой электрод опустить в насыщенный раствор хлорида калия, то концентрация хлорид ионов будет постоянная и потенциал хлорсеребряного электрода будет постоянным, т.е. удовлетворять требованию электродов сравнения.
Индикаторные электроды.
Индикаторный электрод - электрод, потенциал которого зависит от концентрации определяемых ионов в растворе.
Требования к индикаторным электродам.
1). Должны быть обратимы по отношению к одному из ионов, участвующих в химической реакции.
2). Не должен взаимодействовать с ионами, находящимися в растворе, т.е. должен быть индифферентным.
3). Должен концентрационно правильно и мгновенно реагировать на изменение концентрации потенциалопределяющего иона.
В качестве индикаторных электродов в потенциометрическом методе анализе используется металлические и мембранные ионоселективные электроды (ИСЭ).
Металлические электроды. Это электроды первого рода. Они представляют металлический электрод, опущенный в раствор собственной соли. Например, серебряный электрод, это серебряная проволока, опущенная в раствор собственной соли (AgNO3), содержащей ионы серебра.
Слайд4
Реакция в растворе Ag+ + Cl- → AgCl
Электрохимическая реакция на электроде
Ag+ + e → Ag0↓
E = E0 + 0,059 lg C (Ag+)
Таким образом, потенциал серебряного электрода зависит от природы металла (EoAg+/Ag) и концентрации ионов серебра Ag+ в растворе, т.е. является индикаторным электродом для ионов серебра.
Серебряный электрод можно применять для определения ионов серебра.
Для определения ионов ртути (I) нужен ртутный электрод.
В общем виде потенциал электрода первого рода равен

Таким образом, потенциал металлического электрода зависит от концентрации потенциалопределяемых ионов в растворе.
Слайд5
Индикаторные электроды из благородных металлов (платина, золото, палладия) являются индикаторными для окислительно-восстановительных систем.
Их потенциал выражается уравнением Нернста

В этом случае металлы являются лишь переносчиками электронов от восстановленной формы к окисленной. Их потенциалы зависят от соотношения концентраций окисленной и восстановленной форм системы. Электроды из платины (и золота) используют при потенциометрическом окислительно – восстановительном титровании.
Ионоселективные мембранные электроды. Ионоселективным называется электрод на основе мембраны, потенциал которой линейно зависит от десятичного логарифма концентрации определяемого иона в растворе.
Основной частью такого электрода является полупроницаемая мембрана – тонкая плёнка растворов электролитов, твёрдый или стекловидный электролит.
При соприкосновении поверхности с раствором происходит обмен ионами между мембраной и раствором. Таким образом, если возникновение потенциала на металлических электродах связано с переносом электронов через границу раздела электрод – раствор, то в случае мембранных электродов – с обменом ионами между материалом мембраны и раствором.
Слайд 6
Потенциал ионоселективного электрода

где k – постоянная, зависящая от конструкции электрода:
знак ± зависит от заряда иона (плюс – для катионов, минус – для анионов); z – заряд иона; С(А) – концентрация иона.
В зависимости от материала мембранные электроды подразделяются на стеклянные, с твёрдой, с жидкой мембранами.
Стеклянный электрод – это один из давно известных мембранных электродов, широко используемых для определения pH, т.е. концентрации ионов водорода.
Слайд 7 (стеклянный электрод)
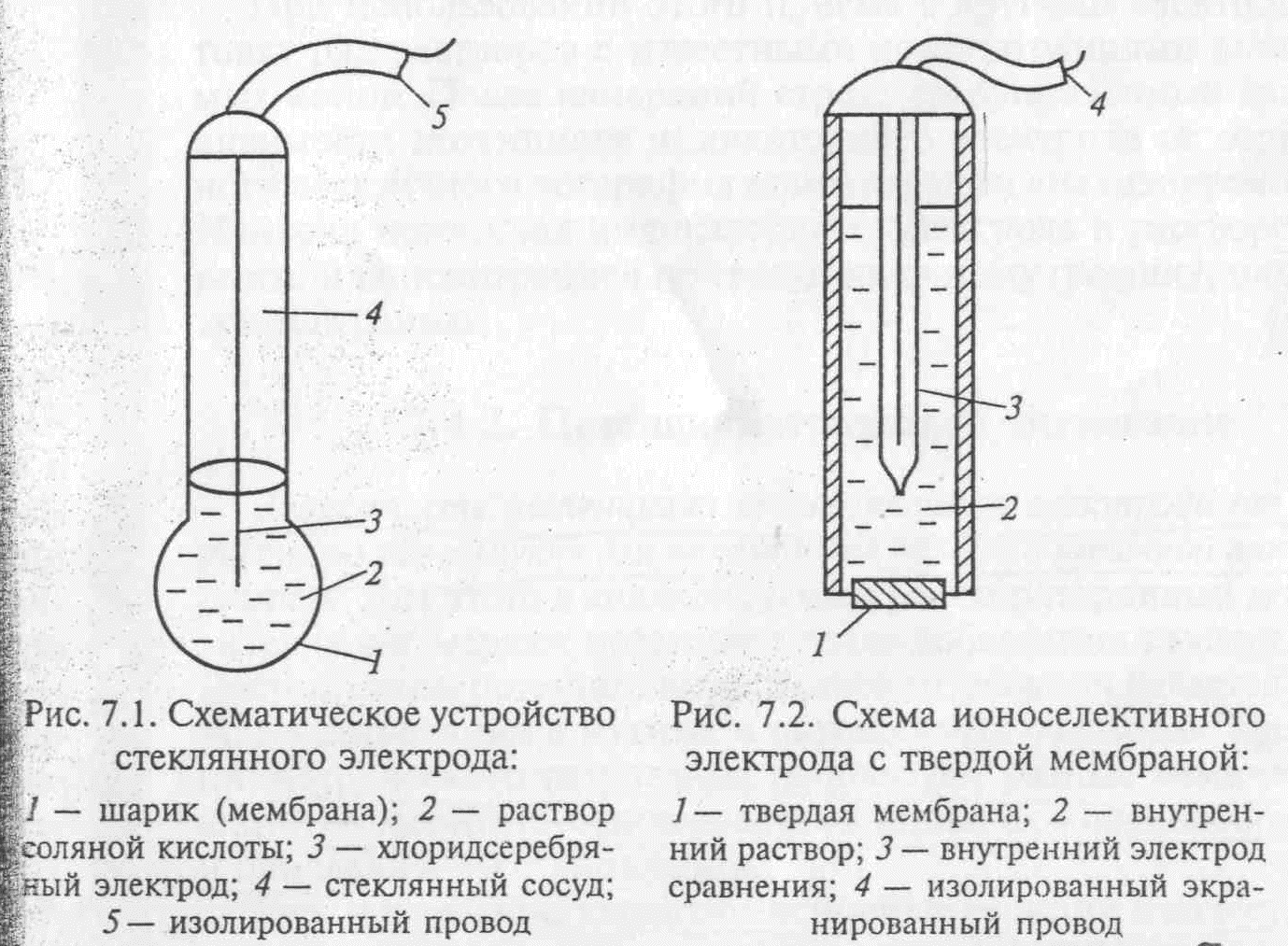
Этот электрод представляет небольшой стеклянный сосуд, к нижней части которого припаян шарик из стекла специального состава. В сосуд заливают 0,1 М раствор соляной кислоты. В этот внутренний раствор погружён хлорсеребряный электрод – серебряная проволока, покрытая хлоридом серебра. К серебряной проволоке припаян изолированный экранированный провод.
Стеклянный электрод обычно используют при измерениях pH с хлорсеребряным электродом сравнения.
Стеклянный шарик изготовлен из специального стекла, содержащий оксиды: натрия, кальция, лития, кремния.
При опускании стеклянного электрода в раствор, содержаний ионы водорода, идёт обменная реакция.
Слайд 8.
Na+стекло + H+р-р→ H+стекло + Na+р-р
E = k – 0,059pH
где k = const зависит от сорта стекла и устройства электрода
Концентрация во внешней и внутренней частях мембраны разная. Поэтому на границе раздела стекло – исследуемый раствор возникает потенциал, который зависит от концентрации ионов водорода в исследуемом растворе, т.е. от pH.
Преимущества стеклянного электрода
1). На измерение pH не влияют посторонние ионы.
2). Потенциал устанавливается быстро.
3). Не отравляется.
4). Пригоден для измерения в широком диапазоне pH: от 1 до 14.
Недостатки.
1). Хрупкость стеклянного шарика.
ЭЛЕКТРОДЫ С ТВЁРДЫМИ МЕМБРАНАМИ
В них используют тонкие пластины (мембраны) из веществ, мало растворимых и проводящих ток за счёт ионов. Например, фтор селективный электрод с мембраной из кристаллического три фторида лантана. Этим электродом можно измерять вторичную концентрацию фторид-ионов от 1 до 10-6 моль/л.
ЭЛЕКТРОДЫ С ЖИДКИМИ МЕМБРАНАМИ
В них используют мембрану в виде пористой полимерной плёнки, пропитанной раствором электропроводного вещества в органическом растворителе. Один из ионов электродного вещества обменивается с ионом, находящимся в водном растворе. Такие электроды используются для определения нитрат ионов, хлорид-ионов, бромит-ионов, иодит-ионов, катионов калия, натрия, кальция и др.
