
- •Лабораторна робота 4
- •2.1. У результаті проведення лабораторного заняття студенти повинні:
- •2.2. Самостійна робота на занятті:
- •3. Реактиви і обладнання:
- •4. Теоретичні відомості
- •4.1. Загальна характеристика методу
- •4.1.1. Умови фотометричних визначень
- •4.1.2. Схема фотометричного визначення
- •4.2. Фотометричні методи кількісного визначення речовин
- •4.2.1. Метод порівняння
- •4.2.2. Метод калібрувального графіка
- •4.3. Прилади фотометричного аналізу
- •4.3.1. Загальна характеристика фотоелектроколориметра кфк-2.
- •4.3.2. Будова фотоелектроколориметра кфк-2.
- •4.3.3. Підготовка до роботи на фотоелектроколориметрі кфк-2
- •4.4. Загальні вказівки до виконання лабораторної роботи
- •5. Зміст роботи.
- •5.1. Методика проведення визначень
- •5.1.1. Приготування еталонного розчину.
- •5.1.2. Приготування серії стандартних розчинів.
- •5.1.3. Вибір світлофільтру і кювети.
- •5.1.4. Побудова калібрувального графіку.
- •Контрольні запитання
- •Література
5.1.2. Приготування серії стандартних розчинів.
Для побудови калібрувального графіка готують 5 стандартних розчинів, які містять 0,2, 0,4, 0,6, 0,8 і 1,0 мг фосфору в 50 мл розчину. Для цього в 5 мірних колб на 50 мл вносять об’єм еталонного розчину, який містить 0,2, 0,4, 0,6, 0,8, і 1 мг фосфору – 2, 4, 6, 8, і 10 мл еталонного розчину відповідно.
В кожну колбу додають 10 мл 1,25 М нітратної кислоти, 10 мл 0,25%-го розчину амоній метаванадату і 10 мл 10%-го розчину амоній молібдату, перемішуючи розчини після введення кожного реагенту. Об’єми всіх розчинів доводять до 50 мл дистильованою водою і перемішують. Поглинання отриманих розчинів вимірюють не менше ніж через 30 хв після їх приготування.
Розчин порівняння містить передбачені методикою кількості всіх компонентів, за виключенням еталонного розчину солі фосфору.
5.1.3. Вибір світлофільтру і кювети.
Розчин, який має найінтенсивніше забарвлення, фотометрують відносно розчину порівняння зі всіма світлофільтрами по черзі. Для подальшої роботи вибирають світлофільтр, який відповідає найбільшому світлопоглинанню вимірюваного розчину.
Підбирають кювету з таким розрахунком, щоб значення оптичної густини розчину порівняння при вибраному світлофільтрі вкладалося в інтервал 0,20-0,45.
5.1.4. Побудова калібрувального графіку.
З вибраним світлофільтром фотометрують всі стандартні розчини відносно розчину порівняння. Для кожного розчину вимірюють оптичну густину 4 рази, знаходять середнє значення і дані вносять в таблицю:
Вміст Р5+ в 1 мл розчину, мг |
Оптичні густини при вимірюваннях |
Середнє значення |
|||
1 |
2 |
3 |
4 |
||
1 0,8 0,6 0,4 0,2 0,05 |
|
|
|
|
|
В
D
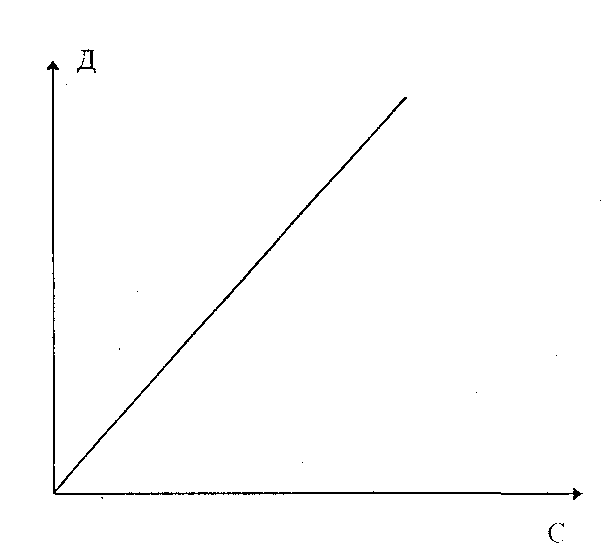
Рис. 6. Залежність оптичної густини розчину від його концентрації
5
С,
мг/мл
До досліджуваногорозчину, виданого викладачем, додають 10 мл 1,25 М нітратної кислоти, 10 мл 0,25%-го розчину амоній метаванадату і 10 мл 10%-го розчину амоній молібдату, перемішуючи розчини після введення кожного реагенту. Об’єм розчину доводять до 50 мл дистильованою водою і ретельно перемішують. Через 30 хв приготовлений розчин фотометрують відносно розчину порівняння. Вимірювання повторюють 5 раз і, користуючись калібрувальним графіком, знаходять вміст фосфору в контрольному розчині.
Контрольні запитання
1.Фізико-хімічні методи аналізу, їх перевага та взаємозв’язок із хімічними методами аналізу.
2. Як класифікують фотометричні методи аналізу?
3. Теоретичні основи фотоколориметрії. Спектр поглинання.
4. Сформулюйте закон Бугера-Ламберта-Бера і запишіть для нього математичний вираз. Відхилення від закону.
5. Що таке оптична густина розчину? Як вона залежить від концентрації речовини та товщини поглинаючого шару розчину?
6. Що таке молярий коефіцієнт поглинання і від чого він залежить?
7. Поясніть принцип роботи фотоколориметра.
8. Практичне застосування фотоколориметричного аналізу.
