
- •4. Основные физико-химические закономерности химической технологии
- •4.1. Равновесие в химической технологии
- •4.1.1.Принцип Ле Шателье и его практическое применение
- •Таким образом, 1-я реакция протекает с максимальным уменьшением объема, поэтому при увеличении объема скорость этой реакции (чувствительность) будет наибольшей, что повышает селективность процесса.
- •4.2. Скорость химико-технологических процессов
- •4.2.1. Понятия о микро- и макрокинетике
- •4.2.2. Общая кинетическая модель химико-технологического процесса
- •4.2.2.1. Гомогенные процессы
- •4.2.2.2. Гетерогенные процессы
- •4.2.3. Скорость гомогенных реакций и методы их интенсификации
- •4.2.4. Влияние температуры на скорость химических реакций
- •4.2.5. Влияние давления на скорость химических реакций
- •4.2.6. Влияние катализатора на скорость химических реакций
- •4.2.7. Скорость гетерогенных процессов и методы их интенсификации
- •4.2.7.1. Методы интенсификации гетерогенных процессов
- •Увеличение коэффициента массопередачи.
- •Увеличение поверхности контакта фаз.
- •4.2.8 Методы определения лимитирующей стадии процесса
- •4.2.9. Факторы, ограничивающие повышение температуры
4.2.2.2. Гетерогенные процессы
Скорость взаимодействия реагентов, находящихся в разных фазах зависит не только от скорости химической реакции, но и от многих других факторов (как любой процесс, протекающий на макроуровне).
К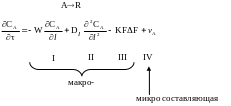 инетическая
модель химико-технологического процесса
инетическая
модель химико-технологического процесса
K – коэффициент массопередачи; F – поверхность контакта;
I – физический фактор, характеризующий гидродинамику идеального аппарата;
II – характеризует отклонение гидродинамических реакторов от идеальности при наличии продольного перемешивания;
III – характеризует межфазный переход вещества в гетерогенных процессах т. е. учитывает гетерогенность системы;
IV – характеризует процесс химического превращения;
![]() – конвективный
перенос, учитывающий влияние гидродинамики.
– конвективный
перенос, учитывающий влияние гидродинамики.
4.2.3. Скорость гомогенных реакций и методы их интенсификации
Для гомогенных систем характерно идеальное перемешивание на молекулярном уровне, поэтому молекулы реагирующих веществ равномерно распределены по всему реакционному объему, в любой точке которого возможно их взаимодействие. В связи с этим, гомогенные процессы лежат в кинетической области, и их скорость определяется скоростью химической реакции.
Для снижения расходного коэффициента сырья технологический процесс необходимо вести так, чтобы степень превращения, выход целевого продукта и селективность были возможно более высокими и достигались в возможно более короткое время, т. е. скорость процесса должна быть возможно более высокой. Это объясняется тем, что скорость характеризует интенсивность процесса, а интенсивность является одним из основных показателей, определяющих экономичность химического производства.
Скорость химической реакции определяется количеством прореагировавшего исходного вещества или количеством полученного целевого продукта в единицу времени в единице объема системы. Так, скорость реакции
A R
выражается уравнением
![]() , (4.2.)
, (4.2.)
где V – реакционный объем; N – число молей исходного компонента.
Скорость
реакции всгда положительна, поэтому
знак перед производной
![]() должен определяться тем, является ли
вещество А исходным реагентом (тогда
отрицательна)
или продуктом (тогда
положительна).
должен определяться тем, является ли
вещество А исходным реагентом (тогда
отрицательна)
или продуктом (тогда
положительна).
Если объем системы не изменяется в течение реакции, тогда из уравнения (4.2.) следует:
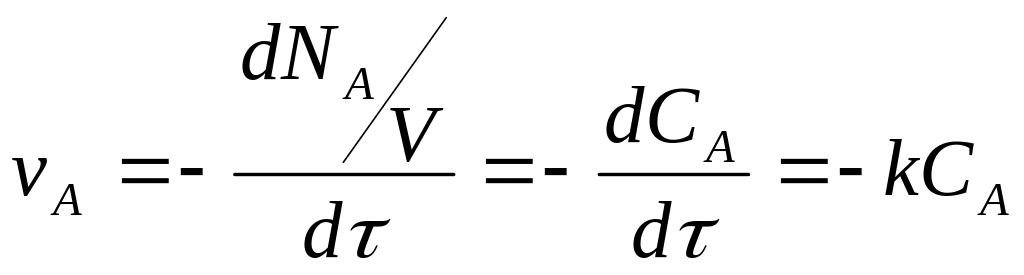 ,
,
где k – константа скорости реакции.
Д ля
обратимой реакции:
ля
обратимой реакции:
у
![]()
где
![]() - равновесные концентрации компонентов
А и В.
- равновесные концентрации компонентов
А и В.
Концентрация реагирующих веществ оказывает влияние на скорость реакции всех типов: с увеличением концентрации исходных реагентов скорость реакции возрастает.
Т ак,
для реакции:
ак,
для реакции:
суммарная
скорость равна разности между скоростями
прямой и обратной реакций:
![]()
Т. е. чем больше значения СА и СВ, тем выше vсумм, и еще: с течением времени суммарная скорость реакции vсумм снижается, т. к. концентрации исходных реагентов (СА, СВ) уменьшаются, а концентрации продуктов реакции (СR, СS) увеличиваются.
![]()
![]()
тогда vсумм = k1 С1 – k2 С2.
Физический смысл выражения: скорость химической реакции зависит от количества столкновений молекул. Чем выше концентрация, тем больше встреч (столкновений), тем больше скорость.
Для того, чтобы судить об изменении скорости реакции, строят кривые зависимостей концентраций реагентов, участвующих в реакции, от времени, те устанавливают зависимость С = f ().
Рассмотрим эту зависимость для различных реакций.
Необратимая реакция (простая):
![]()
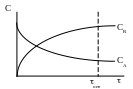
![]()
Из рис. видно, что СА снижается по экспоненциальному закону, соответственно уменьшается и скорость реакции. При этом, чтобы довести реакцию до конца, необходимо большое время , т. к. СА асимптотически приближается к нулю.
На практике реакцию не доводят до конца, ее останавливают через некоторый промежуток времени, когда СА0 и движущая сила процесса (С) еще достаточно велика; такое время можно назвать оптимальным – опт. В результате того, что реакция проходит не полностью, в конце процесса получают смесь продуктов A и R. Следовательно, процесс следует организовывать таким образом, чтобы после стадии химического превращения была стадия разделения, а также, чтобы после выделения продукта R исходный реагент А вновь был использован в реакции, т. е. процесс необходимо организовать по циклической схеме.
П
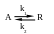 ростая
обратимая реакция
ростая
обратимая реакция
С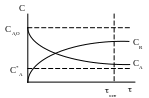 корость
реакции определяется уравнениями:
корость
реакции определяется уравнениями:
![]()
З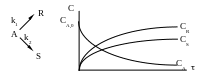 ависимость
более сложная (см. рис.): процесс
останавливается в тот момент, когда
концентрация исходного реагента СА
достигает значения концентрации этого
реагента в состоянии равновесия
ависимость
более сложная (см. рис.): процесс
останавливается в тот момент, когда
концентрация исходного реагента СА
достигает значения концентрации этого
реагента в состоянии равновесия
![]() .
Поскольку вблизи равновесия скорость
взаимодействия очень мала, процесс
прекращают по достижении некоторого
оптимального времени опт,
при котором разность
.
Поскольку вблизи равновесия скорость
взаимодействия очень мала, процесс
прекращают по достижении некоторого
оптимального времени опт,
при котором разность
![]() (С) еще значительная
и, следовательно, скорость процесса
достаточно высока.
(С) еще значительная
и, следовательно, скорость процесса
достаточно высока.
Сложные необратимые параллельные реакции:
![]()
![]()
С
 ложные
необратимые последовательные реакции:
ложные
необратимые последовательные реакции:
![]()
скорость таких реакций выражается уравнениями:
![]()
![]()
![]()
Максимальной
концентрации промежуточный продукт СR
достигает при условии:
![]()
С течением времени значение СА снижается, а СR сначала увеличивается, достигает некоторого максимального значения, а затем убывает вследствие его разложения и образования продукта S. При этом концентрация промежуточного продукта R в некоторый момент времени зависит от соотношения скоростей каждой из последовательных реакций.
Различают три случая:
Если k1k2, то при прочих равных условиях, при полном расходе продукта А образуется смесь, содержащая продукты R и S (рис. 4.9.).
Если k1k2, то промежуточный продукт R по мере его образования интенсивно расходуется, поэтому с самого начала реакции происходит накопление S (рис. 4.10.).
Е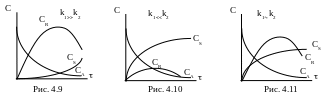 сли
k1k2,
то кривые зависимости CR = f()
и CS = f() занимают
промежуточное положение между кривыми,
соответствующими k1k2
и k1k2
(рис. 4.11.).
сли
k1k2,
то кривые зависимости CR = f()
и CS = f() занимают
промежуточное положение между кривыми,
соответствующими k1k2
и k1k2
(рис. 4.11.).
