
- •4. Основные физико-химические закономерности химической технологии
- •4.1. Равновесие в химической технологии
- •4.1.1.Принцип Ле Шателье и его практическое применение
- •Таким образом, 1-я реакция протекает с максимальным уменьшением объема, поэтому при увеличении объема скорость этой реакции (чувствительность) будет наибольшей, что повышает селективность процесса.
- •4.2. Скорость химико-технологических процессов
- •4.2.1. Понятия о микро- и макрокинетике
- •4.2.2. Общая кинетическая модель химико-технологического процесса
- •4.2.2.1. Гомогенные процессы
- •4.2.2.2. Гетерогенные процессы
- •4.2.3. Скорость гомогенных реакций и методы их интенсификации
- •4.2.4. Влияние температуры на скорость химических реакций
- •4.2.5. Влияние давления на скорость химических реакций
- •4.2.6. Влияние катализатора на скорость химических реакций
- •4.2.7. Скорость гетерогенных процессов и методы их интенсификации
- •4.2.7.1. Методы интенсификации гетерогенных процессов
- •Увеличение коэффициента массопередачи.
- •Увеличение поверхности контакта фаз.
- •4.2.8 Методы определения лимитирующей стадии процесса
- •4.2.9. Факторы, ограничивающие повышение температуры
4.2. Скорость химико-технологических процессов
Рассмотренные термодинамические закономерности равновесия позволяют решить вопрос о направлении протекания химических реакций и определить лишь максимально возможный (теоретический) выход продукта. Химическая термодинамика не может ответить на вопросы, имеющие чрезвычайно важное практическое значение в химической технологии, а именно: как быстро произойдет химическое превращение, за какой промежуток времени будет получено то или иное количество продукта реакции.
Решающее значение при выборе условий проведения химико-технологических процессов имеют вопросы скорости химических превращений, изучаемые химической кинетикой.
Для химической технологии важен конечный результат кинетических исследований- конкретный вид уравнения, позволяющего рассчитывать скорость химической реакции при различных условиях ее проведения. Кинетические уравнения, содержащие необходимую информацию об основных закономерностях химических превращений, являются основой математической модели химического реактора. Без знания кинетических закономерностей невозможно выбрать тип и рассчитать конструктивные параметры реактора.
4.2.1. Понятия о микро- и макрокинетике
Процессы, протекающие в жидкостях и газах, обычно рассматриваются с двух точек зрения: процесс взаимодействия отдельных молекул – на микроуровне, и процесс взаимодействия агрегатов молекул – на макроуровне.
В системе на микроуровне жидкость представляет собой свободные индивидуальные молекулы, движущиеся в различных направлениях, сталкивающиеся и смешивающиеся со всеми другими молекулами данной жидкости.
В системе на макроуровне жидкость представляет собой совокупность большого числа небольших глобул, т. е. групп молекул, как бы заключенных в оболочку.
Особенности микро- и макросостояния можно проследить при смешении жидкостей: чем выше вязкость смешиваемых жидкостей, тем ярче проявляются в ней признаки макросостояния:
Смешивание воды с этиловым спиртом – смешение на микроуровне.
Смешивание воды с глицерином – смешение на микроуровне.
Все вопросы, изучаемые в курсе физхимии, – химическое равновесие, кинетика химических реакций – рассматриваются на микроуровне, т.е. на уровне отдельных молекул. Такой подход позволяет проанализировать влияние различных факторов в идеализированных условиях.
В промышленных условиях необходимо учитывать многие сопутствующие физические процессы, связанные с макросостоянием системы и влияющие на основной химический процесс, а именно: 1) диффузия исходных реагентов в зону реакции и продуктов реакции из зоны реакции, 2) выделение и распределение тепла. На оба эти процесса сильное влияние оказывают аэрогидродинамические условия (т. е. характер движения газов. и жидкостей.), т. к. от них зависят конвективный перенос тепла и диффузия вещества.
4.2.2. Общая кинетическая модель химико-технологического процесса
4.2.2.1. Гомогенные процессы
Скорость реакции в гомогенных системах более высокая, чем в гетерогенных, т. к. в первом случае реакции протекают на уровне отдельных молекул.
Гомогенные процессы в большинстве случаев протекают в кинетической области, т.е. общая скорость процесса определяется скоростью химической реакции и подчиняется закономерностям, установленным для процессов, протекающим на микроуровне.
В
AR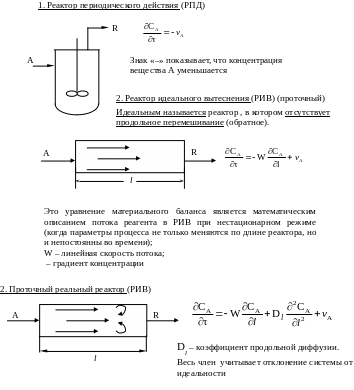 основе гомогенных процессов лежат
простые необратимые реакции вида:
основе гомогенных процессов лежат
простые необратимые реакции вида:
Гидродинамическая обстановка в данном реакторе отличается от обстановки в идеальном реакторе. В частности, в реальном реакторе вытеснения помимо поршневого движения основного потока по длине реактора, возможно перемешивание потока в продольном и радиальном направлениях.
При учете радиального перемешивания формула усложняется.
Гомогенный процесс на макроуровне протекает в том случае, когда на химическую реакцию накладываются другие физические или физико-химические процессы. Например, при взаимодействии двух жидких исходных реагентов или их растворов скорость гомогенного процесса зависит от условий и скорости перемешивания жидкостей; если химическое взаимодействие протекает при подогреве, то скорость гомогенного процесса будет зависеть также от способа подвода тепла.
