
- •4. Основные физико-химические закономерности химической технологии
- •4.1. Равновесие в химической технологии
- •4.1.1.Принцип Ле Шателье и его практическое применение
- •Таким образом, 1-я реакция протекает с максимальным уменьшением объема, поэтому при увеличении объема скорость этой реакции (чувствительность) будет наибольшей, что повышает селективность процесса.
- •4.2. Скорость химико-технологических процессов
- •4.2.1. Понятия о микро- и макрокинетике
- •4.2.2. Общая кинетическая модель химико-технологического процесса
- •4.2.2.1. Гомогенные процессы
- •4.2.2.2. Гетерогенные процессы
- •4.2.3. Скорость гомогенных реакций и методы их интенсификации
- •4.2.4. Влияние температуры на скорость химических реакций
- •4.2.5. Влияние давления на скорость химических реакций
- •4.2.6. Влияние катализатора на скорость химических реакций
- •4.2.7. Скорость гетерогенных процессов и методы их интенсификации
- •4.2.7.1. Методы интенсификации гетерогенных процессов
- •Увеличение коэффициента массопередачи.
- •Увеличение поверхности контакта фаз.
- •4.2.8 Методы определения лимитирующей стадии процесса
- •4.2.9. Факторы, ограничивающие повышение температуры
Таким образом, 1-я реакция протекает с максимальным уменьшением объема, поэтому при увеличении объема скорость этой реакции (чувствительность) будет наибольшей, что повышает селективность процесса.
Влияние инертного газа.
Введение инертного газа в систему при p = const подобно эффекту уменьшения общего давления:N2 + 2SO2 + O2 ⇄ 2SO3
Если реакция протекает с уменьшением числа молей (∆n < 0), разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов; при увеличении числа молей (∆n > 0) равновесие смещается вправо.: N2 + CH4 ⇄ C + 2H2
Поэтому в технологических системах, сопровождаемых химическими реакциями, для которых ∆n < 0, стремятся к уменьшению накопления инертных газов в системе.
Выводы о влиянии инертного газа непосредственно следуют из закона Дальтона:
![]() ,
,
![]() ,
,
![]() ,
,![]()
из
которого видно, что эффект разбавления
(уменьшения ni)
подобен эффекту уменьшения общего
давления
![]() в системе.
в системе.
Изменение концентрации.
В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия в том направлении, при котором концентрация этого вещества уменьшается.
Поэтому введение избытка исходных веществ смещает равновесие вправо; введение избытка продукта реакции вызывает смещение равновесия влево.
Так, для реакции:
СО + Н2О ⇄ СО2 + Н2 + Q (4.1.)
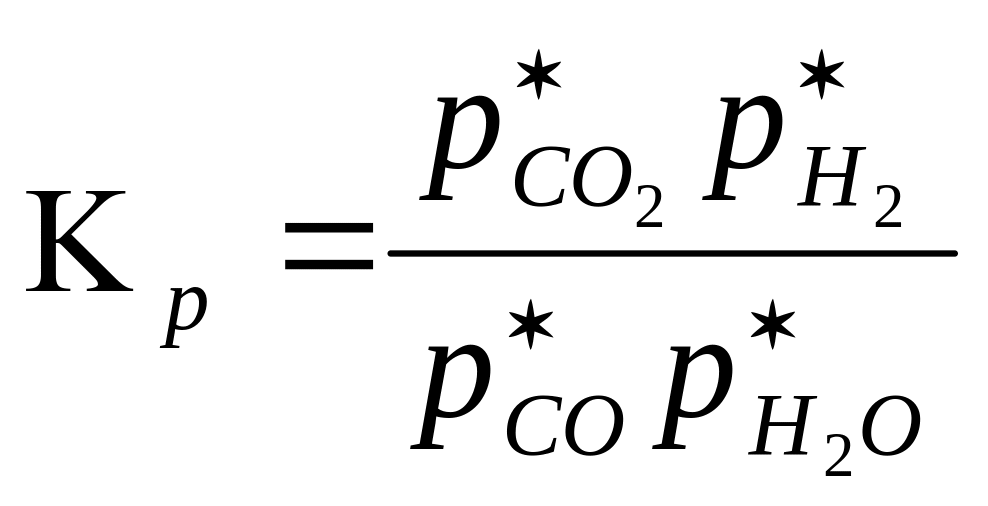
При увеличении концентрации исходных реагентов, т. е. при увеличении знаменателя, соответственно возрастает числитель, т. е. повышаются концентрации продуктов реакции (поскольку Кр для данной t величина постоянная Кр = const). С другой стороны, при уменьшении концентрации продуктов реакции, т. е. при уменьшении числителя, соответственно снижаются концентрации исходных веществ, т. е. увеличивается степень их переработки. Оба эти фактора используются на практике для сдвига равновесия в сторону получения целевого продукта и, следовательно, для увеличения его выхода.
Увеличивая концентрацию одного из реагентов (создавая его избыток!), можно повысить степень превращения другого. В избытке обычно берется более дешевое сырье (Н2О!). Иногда приходится пользоваться другими соображениями. Так, при синтезе HCl:
Сl2 + Н2 ⇄ 2HCl – Q
присутствие хлора в HCl нежелательно, т. к. он загрязняет соляную кислоту, а наличие Н2 не вызывает затруднений. Поэтому, применяя газовую смесь с избытком Н2, получают продукционный газ, почти не содержащий хлора.
Для увеличения выхода целевого продукта можно применить вывод продуктов из реакционной зоны- т. е. уменьшить концентрацию продукта. Это можно достичь двумя путями:
перевести все продукты, или один из них в другое фазовое состояние и вывести из системы;
химическим связыванием с другими веществами, вводимыми извне.
Первый путь заключается в использовании циркуляционной (циклической) схемы. Типичный пример:
N2 + 3H2 ⇄ 2NH3 + Q

H2 + N2
↓–34 0C NH3
(ж)
Второй путь: в процессе (4.1.) для удаления СО2 используют СаО:
СаО + СО2 → СаСО3
При этом снижается
![]() ,
но поскольку Кр при данной температуре
величина постоянная, то концентрация
Н2 возрастает и равновесие реакции
(4.1) сдвигается вправо.
,
но поскольку Кр при данной температуре
величина постоянная, то концентрация
Н2 возрастает и равновесие реакции
(4.1) сдвигается вправо.
