
- •4. Основные физико-химические закономерности химической технологии
- •4.1. Равновесие в химической технологии
- •4.1.1.Принцип Ле Шателье и его практическое применение
- •Таким образом, 1-я реакция протекает с максимальным уменьшением объема, поэтому при увеличении объема скорость этой реакции (чувствительность) будет наибольшей, что повышает селективность процесса.
- •4.2. Скорость химико-технологических процессов
- •4.2.1. Понятия о микро- и макрокинетике
- •4.2.2. Общая кинетическая модель химико-технологического процесса
- •4.2.2.1. Гомогенные процессы
- •4.2.2.2. Гетерогенные процессы
- •4.2.3. Скорость гомогенных реакций и методы их интенсификации
- •4.2.4. Влияние температуры на скорость химических реакций
- •4.2.5. Влияние давления на скорость химических реакций
- •4.2.6. Влияние катализатора на скорость химических реакций
- •4.2.7. Скорость гетерогенных процессов и методы их интенсификации
- •4.2.7.1. Методы интенсификации гетерогенных процессов
- •Увеличение коэффициента массопередачи.
- •Увеличение поверхности контакта фаз.
- •4.2.8 Методы определения лимитирующей стадии процесса
- •4.2.9. Факторы, ограничивающие повышение температуры
4.1.1.Принцип Ле Шателье и его практическое применение
Положение равновесия всегда зависит от внешних условий, а так как внешние условия не могут сохраняться неизменными, то равновесие рано или поздно нарушается (смещается).
Влияние основных параметров технологического режима на равновесие в гомогенных и гетерогенных системах определяется принципом Ле Шателье, выражающим 2-й закон термодинамики.
Согласно этому принципу в системе, выведенной внешним воздействием из состояния равновесия, происходят изменения, направленные к ослаблению воздействий, выводящих систему из равновесия. Другое определение: если на систему, находящуюся в равновесии производится внешнее воздействие (Т, Р, С), то оно благоприятствует той из двух противоположных реакций, которая его ослабляет.
Влияние температуры
Температура является мерой внутренней энергии системы, поэтому направление смещения равновесия при изменении температуры зависит от знака теплового эффекта реакции.
Повышение температуры всегда благоприятствует накоплению веществ, образующихся в данной реакции с поглощением теплоты, т. е. усиливает эндотермическое направление реакции.
Понижение температуры действует в противоположную сторону, т. е. усиливает экзотермическое направление.
О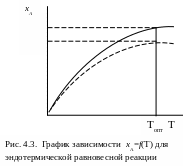 бщим
для обоих случаев является то, что при
изменении температуры равновесие
смещается тем сильнее, чем большим
тепловым эффектом сопровождается та
или иная химическая реакция.
бщим
для обоих случаев является то, что при
изменении температуры равновесие
смещается тем сильнее, чем большим
тепловым эффектом сопровождается та
или иная химическая реакция.
Так, в случае реакций типа:
1. А ⇄ R – Q – эндотермическая реакция
Рассмотрим
график зависимости хА=f(T)
(рис. 4.3.). Фактическая степень превращения
компонента А меньше теоретической (хА,
![]() ).
Так как в сос-тоянии равновесия
).
Так как в сос-тоянии равновесия
![]() ,
то даль-нейшее повышение Т нецелесообразно.
При Топт достигается максимально
возможная степень превращения вещества
А. Например, при крекинге метана
,
то даль-нейшее повышение Т нецелесообразно.
При Топт достигается максимально
возможная степень превращения вещества
А. Например, при крекинге метана
СН4 ⇄ С + 2Н2 – Q
п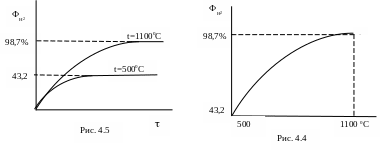 ри
повышении температуры равновесие
смещается вправо и график зависимости
ФН2=f(t)
(рис. 4.4.) и ФН2=f()
(рис. 4.5.) имеют следующий вид.
ри
повышении температуры равновесие
смещается вправо и график зависимости
ФН2=f(t)
(рис. 4.4.) и ФН2=f()
(рис. 4.5.) имеют следующий вид.
2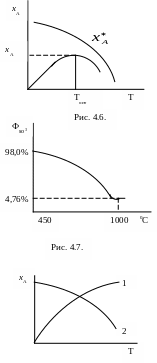 .
А ⇄
R + Q – экзотермическая реакция
.
А ⇄
R + Q – экзотермическая реакция
В этом случае зависимость хА=f(T) имеет более сложный характер (рис. 4.6.).
В начальный момент реакции с повышением Т степень превращения хА увеличивается и достигает максимального значения при Топт. В дальнейшем за счет выделяющегося тепла повышается температура реакционной смеси, равновесие сдвигается влево и равновесная концентрация целевого продукта R уменьшается.
Пример реакции:
2SO2 + O2 ⇄2SO3 + Q
В этом случае зависимость выхода SO3 от температуры имеет следующий вид (рис. 4.7.).
Таким образом, при повышении температуры равновесие обратимого процесса смещается в сторону эндотермической реакции, а при повышении температуры – в сторону экзотермической реакции (рис. 4.8).
Рис. 4.8. График зависимости хА=f(T) для
обратимых реакций
1 – эндотермическая реакции,
2 – экзотермические реакции.
Функциональная зависимость константы равновесия от температуры при постоянном давлении передается уравнением изобары Вант-Гоффа (в дифференциальной форме):
![]() ,
,
где
![]() –
изменение энтальпии при стандартном
состоянии (тепловой эффект реакции).
–
изменение энтальпии при стандартном
состоянии (тепловой эффект реакции).
При положительных
значениях ∆Н
(эндотермические реакции)
![]() и
и
![]() – возрастающая функция. Если ∆Н
< 0 (экзотермические реакции), то
– возрастающая функция. Если ∆Н
< 0 (экзотермические реакции), то
![]() и константа равновесия уменьшается с
повышением температуры.
и константа равновесия уменьшается с
повышением температуры.
После интегрирования этого уравнения в пределах изменения температуры от Т1 до Т2 и при условии, что ∆Н не зависит от величины Т, получаем:
![]()
Влияние давления.
Давление является также важным фактором, с помощью которого в производственных условиях регулируют равновесия химических процессов и , следовательно, изменяют максимально возможную степень использования сырья.
Характер влияния давления на равновесие химических реакций определяется знаком изменения числа молей газообразных реагентов ∆n или знаком изменения объема ∆V:
nA + mB ⇄ cD ± Q
Таким образом, фактор давления применим для газофазных реакций
Для этого рассмотрим 3 реакции, в которых общий объем газов в процессе реакции изменяется в различной степени:
в 1-й объем газов уменьшается: N2 + 3H2 ⇄ 2NH3 + Q m + n > c
во 2-й объем газов увеличивается: CH4 ⇄ C + 2H2 − Q m + n < c
в 3-й объем газов остается без изменений: СО + Н2О(Г) ⇄ H2 + СО2 + Q m + n = c
П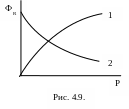 оскольку
для 1-й реакции m + n > c, т. е. она протекает
с уменьшением объема и , следовательно,
с уменьшением давления, то для смещения
равновесия слева направо необходимо
повышать давление. На практике так и
поступают – процесс ведут под давлением.
оскольку
для 1-й реакции m + n > c, т. е. она протекает
с уменьшением объема и , следовательно,
с уменьшением давления, то для смещения
равновесия слева направо необходимо
повышать давление. На практике так и
поступают – процесс ведут под давлением.
Для реакции 2 – m + n < c, т. е. она протекает с увеличением объема, и для смещения равновесия слева направо необходимо наоборот понижать давление.
Поскольку для реакции 3 m + n = c, изменение давления на равновесии не отражается, т. к. объем системы в процессе реакции не изменяется V=const (рис. 4.9.)
Таким образом: при повышении давления равновесие сдвигается в сторону:
целевого продукта, если m + n > c;
исходных реагентов, если m + n < c.
Чувствительность положения равновесия к изменениям давления тем больше, чем большим изменением объема (числа молей) сопровождается тот или иной процесс. Значительные изменения объема могут происходить только в реакциях, в которых участвуют газы, или в тех случаях, когда хотя бы один из компонентов находится в газообразном состоянии.
В сложных системах изменение давления влияет не только на выход, но и на селективность процесса, т. к.
![]()
Так, при синтезе метанола протекает ряд реакций:
1 .
СО+ 2H2 ⇄
СH3ОН целевой продукт
NR
.
СО+ 2H2 ⇄
СH3ОН целевой продукт
NR
2. CО + H2 ⇄ НСНО
3. СО + 3Н2 ⇄ СH4 + Н2О Ni
4. 2СО + 2Н2О ⇄ СH4 + СО2
В 1-й реакции объем уменьшается в 3 раза: 3:1
во 2-й реакции объем уменьшается в 2 раза: 2:1
в 3-й реакции объем уменьшается в 2 раза: 4:2
в 4-й реакции объем уменьшается в 2 раза: 4:2
