
- •4. Основные физико-химические закономерности химической технологии
- •4.1. Равновесие в химической технологии
- •4.1.1.Принцип Ле Шателье и его практическое применение
- •Таким образом, 1-я реакция протекает с максимальным уменьшением объема, поэтому при увеличении объема скорость этой реакции (чувствительность) будет наибольшей, что повышает селективность процесса.
- •4.2. Скорость химико-технологических процессов
- •4.2.1. Понятия о микро- и макрокинетике
- •4.2.2. Общая кинетическая модель химико-технологического процесса
- •4.2.2.1. Гомогенные процессы
- •4.2.2.2. Гетерогенные процессы
- •4.2.3. Скорость гомогенных реакций и методы их интенсификации
- •4.2.4. Влияние температуры на скорость химических реакций
- •4.2.5. Влияние давления на скорость химических реакций
- •4.2.6. Влияние катализатора на скорость химических реакций
- •4.2.7. Скорость гетерогенных процессов и методы их интенсификации
- •4.2.7.1. Методы интенсификации гетерогенных процессов
- •Увеличение коэффициента массопередачи.
- •Увеличение поверхности контакта фаз.
- •4.2.8 Методы определения лимитирующей стадии процесса
- •4.2.9. Факторы, ограничивающие повышение температуры
4.2.8 Методы определения лимитирующей стадии процесса
Расчет реакторов для проведения гетерогенных процессов в системе Г-Т удобно вести, если известна лимитирующая стадия процесса, т.к. в этом случае зависимость между временем пребывания частицы в реакторе и степенью превращения твердого реагента выражается однозначным уравнением. Поэтому важно определить лимитирующую стадию гетерогенного процесса.
Для этой цели наиболее пригодны экспериментальные методы определения лимитирующей стадии. При увеличении значения величины одного из внешних параметров будет увеличиваться скорость той элементарной стадии, которая в большей степени зависит от этого параметра. Так, лимитирующую стадию можно определить экспериментально, изучая изменения скорости гетерогенного процесса в зависимости от температуры, линейной скорости газового потока и степени измельчения твердого материала.
1. По влиянию температуры на скорость химической реакции. Как известно, суммарная скорость процесса зависит от изменения температуры νсум=f(T)
а) Если Wг=const
Ранее было показано, что при увеличении температуры на 100С скорость химической реакции в некоторых случаях возрастает в 2-4 раза.
Скорость диффузии газов зависит от температуры в значительно меньшей степени, приближенно эта зависимость выражается уравнением: D≃aT² т.о., при повышении температуры на 100С скорость диффузии увеличивается всего на 3-5%. Это различное влияние температуры используют для определения лимитирующей стадии процесса.
Так, если опыт показывает, что повышение температуры оказывает сильное влияние на скорость процесса, то процесс протекает в кинетической области (Рис.4.24, область 1).
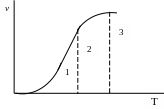 Если при
дальнейшем повышении температуры ее
влияние на скорость общего процесса
уменьшается, значит, процесс перешел в
переходную область (область 2). Если же
далее при повышении температуры общая
скорость процесса практически не
изменяется, значит, процесс протекает
в диффузионной области (3).
Если при
дальнейшем повышении температуры ее
влияние на скорость общего процесса
уменьшается, значит, процесс перешел в
переходную область (область 2). Если же
далее при повышении температуры общая
скорость процесса практически не
изменяется, значит, процесс протекает
в диффузионной области (3).
б) Если Wг ≠const
Рис. 4.24.
В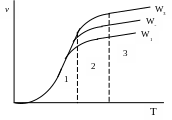 лияние
скорости потока на общую скорость
процесса можно проследить на графике,
отражающем зависимость ν=f(T),
если нанести кривые этой зависимости
для различных скоростей потока(Рис.4.25).
лияние
скорости потока на общую скорость
процесса можно проследить на графике,
отражающем зависимость ν=f(T),
если нанести кривые этой зависимости
для различных скоростей потока(Рис.4.25).
При этом W1<W2<W3. Ход кривых ν=f(W) подтверждает тот факт, что область 3 является диффузионной (с увеличением W скорость процесса возрастает). В области низких температур определяющей стадией является химическая реакция. В этой области скорость процесса возрастает пропорционально температуре. При высоких же температурах скорость
Рис. 4.25.
реакции настолько возрастает, что процесс переходит в диффузионную область, т.е. лимитирует его общую скорость.
 2. Изменение
скорости потока также может быть
использовано для определения
лимитирующей стадии процесса, поскольку
она оказывает существенное влияние
на скорость внешней диффузии.
2. Изменение
скорости потока также может быть
использовано для определения
лимитирующей стадии процесса, поскольку
она оказывает существенное влияние
на скорость внешней диффузии.
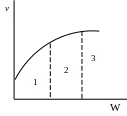
Так, на кривой зависимости общей скорости процесса от скорости потока ν=f(W) при Т=const можно выделить три области: диффузионную, переходную и кинетическую(Рис.4.26).
Рис. 4.26.
В диффузионной области наблюдается значительное влияние скорости потока(область 1), в переходной области влияние скорости потока невелико(область 2), а в кинетической области скорость потока не влияет на скорость процесса(область 3).
3. Влияние степени
зернения твердого материала, ν=f![]() ,
где R- радиус частиц
,
где R- радиус частиц
исходного материала.
Опыты проводят при такой температуре и такой скорости потока когда дальнейшее их увеличение не влияет
на скорость процесса, т.е. Т = const, Wr = const.
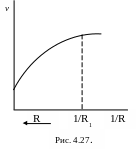 Из графика
видно(Рис.4.27), что при 1/R<1/R1 размер
частиц оказывает влияние на общую
скорость процесса, следовательно, эта
область является внутридиффузионной,
т.е. уменьшение размера частиц оказывает
большое влияние на скорость процесса
(скорость уменьшается).
Из графика
видно(Рис.4.27), что при 1/R<1/R1 размер
частиц оказывает влияние на общую
скорость процесса, следовательно, эта
область является внутридиффузионной,
т.е. уменьшение размера частиц оказывает
большое влияние на скорость процесса
(скорость уменьшается).
4. По энергии активации.
Энергия активации для процессов, лежащих в диффузионной области на 1-2 порядка ниже, чем для процессов, относящихся к кинетической области.
