
- •6.Технология связанного азота
- •6.1.Методы связывания атмосферного азота
- •6.2.Технологические свойства аммиака
- •6.3. Краткий исторический очерк производства
- •6.4. Сырье для производства аммиака
- •6.5. Получение и очистка авс
- •6.5.1.Очистка природного газа от сернистых соединений
- •6.5.2. Получение авс паровоздушной конверсией метана
- •6.5.3. Конверсия с водяным паром
- •6.5.4. Конверсия метана кислородом воздуха
- •6.5.5. Конверсия оксида углерода
- •6.6. Технологическое оформление конверсии природного газа.
- •6.7. Очистка конвертированного газа
- •6.8. Физико-химические основы синтеза аммиака
- •6.9. Технологическая схема производства аммиака
- •6.10. Охрана окружающей среды в производстве аммиака
- •7. Производство азотной кислоты
- •7.1. Технологические свойства азотной кислоты
- •7.2. Общая схема азотнокислотного производства
- •7.3. Физико-химические основы процесса
- •7.3.1. Окисление аммиака до оксида азота (II)
- •7.3.2. Окисление оксида азота (II) и димеризация оксида азота (IV)
- •7.3.3. Абсорбция диоксида азота
- •7.4. Технологические схемы производства разбавленной азотной кислоты
- •7.5. Охрана окружающей среды в производстве азотной кислоты
- •8.Производство серной кислоты
- •8.1. Технологические свойства серной кислоты
- •8.2. Методы получения кислоты
- •8.3. Сырье для производства серной кислоты
- •8.4. Производство серной кислоты из флотационного колчедана.
- •8.4.1.Химическая и принципиальная схема производства
- •8.4.2. Окислительный обжиг колчедана
- •8.4.3. Очистка обжигового газа
- •8.4.4. Контактирование диоксида серы
- •8.4.5. Абсорбция триоксида серы
- •8.5.Производство серной кислоты из серы
- •8.5.1. Особенности технологического процесса
- •8.5.2. Сжигание серы
- •Производство серной кислоты из сероводорода
- •Охрана окружающей среды в производстве серной кислоты.
- •Охрана окружающей среды в химико-технологических процессах.
- •9.1. Процессы нефтепереработки
- •9.2. Металлургическое производство
- •9.2.1. Агломерационное производство
- •9.2.2. Доменное производство
- •9.2.3. Сталеплавильное производство
- •9.2.4. Литейное производство
- •9.2.5. Производство цветных металлов
- •9.3. Коксохимическое производство
- •Производство карбамида
- •Производство аммиачной селитры
- •9.6. Производство метанола
- •Производство формальдегида
- •9.8. Получение циклогексана гидрированием бензола
- •9.9. Производство этилбензола
- •9.10. Получение стирола
- •9.11. Производство дихлорэтана (дхэ)
6.4. Сырье для производства аммиака
Сырьем в производстве аммиака является азотоводородная смесь (АВС) стехиометрического состава N2:H2=1:3. Так как ресурсы атмосферного азота практически неисчерпаемы, сырьевая база аммиачного производства определяется вторым компонентом смеси – водородом, который может быть получен разделением обратного коксового газа, газификацией твердого топлива, конверсией природного газа (рис. 6.1.)
Н2
АВС
АЗОТ
ВОЗДУХ
разделение
газификация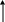
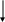

Р
КОКСОВЫЙ ГАЗ
ПРИРОДНЫЙ ГАЗ
конверсия
ТВЕРДОЕ ТОПЛИВО

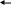

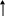
Структура сырьевой базы производства аммиака менялась и сейчас свыше 90% аммиака вырабатывается на основе природного газа. В табл. 6.3 приведена динамика изменения структуры основных видов сырья аммиачного производства.
Таблица 6.3
Изменение сырьевой базы производства аммиака
Виды сырья |
Доля сырья по годам ,% |
Энергоемкость, тонн усл. топлива |
||||
1960 |
1965 |
1970 |
1975 |
1980 |
||
Твердое топливо |
32,0 |
15,9 |
10,4 |
5,7 |
1,5 |
3,73 |
Коксовый газ |
32,1 |
18,2 |
14,2 |
11,7 |
5,3 |
2,07 |
Природный газ |
16,3 |
59,9 |
72,3 |
79,6 |
92,2 |
1,50 |
Азотоводородная смесь, независимого от метода ее получения, содержит примеси веществ, некоторые из которых являются каталитическими ядами, вызывающими как обратимое (кислород, оксиды углерода, пары воды), так и необратимое (различные соединения серы и фосфора) отравление катализатора.
С целью удаления этих веществ АВС подвергается предварительной очистке, методы и глубина которой зависят от их природы и содержания, то есть от способа производства АВС. Обычно, АВС, получаемая конверсией природного газа, содержит оксид углерода (IV), метан, аргон, следы кислорода и до 0,4% об.оксида углерода (II).
6.5. Получение и очистка авс
Синтез аммиака осуществляют из азотоводородной смеси, которую обычно готовят конверсией метана и оксида углерода с водным паром и кислородом воздуха. Полученный таким способом газ носит название синтез-газа.
Синтез-газ из углеводородных газов (природного, попутного, газов переработки других топлив) в настоящее время является основным источником получения аммиака и метанола. По используемому окислителю и технологическому оформлению можно выделить следующие варианты процесса получения водород-содержащих газов: высокотемпературная кислородная конверсия, каталитическая парокислородная конверсия в шахтных реакторах, каталитическая пароуглекислотная конверсия в трубчатых печах.
Стадии получения АВС направляемой на синтез аммиака, приведены ниже:
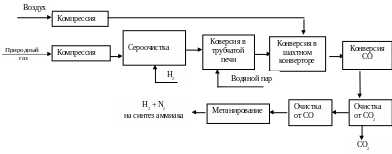
6.5.1.Очистка природного газа от сернистых соединений
Присутствие сернистых соединений в технологических газах нежелательно. Во-первых, они являются сильнодействующими каталитическими ядами, во-вторых, наличие сернистых соединений вызывает коррозию аппаратуры.
Природный газ ряда месторождений содержит значительное количество соединений серы – неорганических и органических. Из неорганических соединений в природном газе содержится только сероводород. Органические сернистые соединения, содержащиеся в природном газе весьма разнообразны. К ним принадлежат сульфидоксид углерода COS, сероуглерод CS2, тиофен C4H4S, сульфиды R2S, дисульфиды R2S2, меркаптаны RSH (метилмеркаптан CH3SH, этилмеркаптан C2H5SH, тяжелые меркаптаны, например C6H5SH).
На основании многочисленных исследований установлено, что чем больше молекулярная масса соединения, тем труднее оно удаляется из газа. Самым трудноудаляемым сераорганическим соединением является тиофен. Плохо удаляются также сульфиды, дисульфиды и тяжелые меркаптаны.
На первой стадии сераорганические соединения гидрируются с использованием алюмокобальтмолибденового или алюмоникельмолибденового катализатора при температуре 350-4000 С и давлении 2-4 МПа. При гидрировании протекают следующие реакции:
C2H5SH+H2=H2S+C2H6
C6H5SH+H2=H2S+C6H6
C4H4S+4H2=H2S+C4H10
CS2+ 4H2=2H2S+CH4
COS+H2=H2S+CO
CH3SC2H5+2H2=H2S+CH4+C2H6
В условиях проведения процесса приведенные выше реакции можно считать необратимыми, т.е. практически достигается полное гидрирование.
На второй стадии происходит хемосорбционное поглощение сероводорода специальным поглотителем (ГИАП –10), содержащим оксид цинка, с которым сероводород при 390-4100 С образует сфалерит
H2S+ZnO→ZnS+H2O
В интервале температур 200-5000С реакция практически необратима и можно обеспечить высокую степень очистки газа, поскольку произведение растворимости ZnS равно 1,9∙10-22.
При повышенном содержании сернистых соединений в природном газе применяется очистка адсорбционным методом с использованием синтетических цеолитов (молекулярных сит). Наиболее подходящим для сероочистки является цеолит марки NaX, в состав которого входят оксиды Na2O, Aℓ2O3, SiO2. Сорбция осуществляется при температуре, близкой к комнатной; регенерируют цеолиты при 300-4000С. Регенерация производится либо азотом, либо очищенным газом при постепенном увеличении температуры, причем основная масса серы (65%) выделяется при 120-2000С.
