
- •6.Технология связанного азота
- •6.1.Методы связывания атмосферного азота
- •6.2.Технологические свойства аммиака
- •6.3. Краткий исторический очерк производства
- •6.4. Сырье для производства аммиака
- •6.5. Получение и очистка авс
- •6.5.1.Очистка природного газа от сернистых соединений
- •6.5.2. Получение авс паровоздушной конверсией метана
- •6.5.3. Конверсия с водяным паром
- •6.5.4. Конверсия метана кислородом воздуха
- •6.5.5. Конверсия оксида углерода
- •6.6. Технологическое оформление конверсии природного газа.
- •6.7. Очистка конвертированного газа
- •6.8. Физико-химические основы синтеза аммиака
- •6.9. Технологическая схема производства аммиака
- •6.10. Охрана окружающей среды в производстве аммиака
- •7. Производство азотной кислоты
- •7.1. Технологические свойства азотной кислоты
- •7.2. Общая схема азотнокислотного производства
- •7.3. Физико-химические основы процесса
- •7.3.1. Окисление аммиака до оксида азота (II)
- •7.3.2. Окисление оксида азота (II) и димеризация оксида азота (IV)
- •7.3.3. Абсорбция диоксида азота
- •7.4. Технологические схемы производства разбавленной азотной кислоты
- •7.5. Охрана окружающей среды в производстве азотной кислоты
- •8.Производство серной кислоты
- •8.1. Технологические свойства серной кислоты
- •8.2. Методы получения кислоты
- •8.3. Сырье для производства серной кислоты
- •8.4. Производство серной кислоты из флотационного колчедана.
- •8.4.1.Химическая и принципиальная схема производства
- •8.4.2. Окислительный обжиг колчедана
- •8.4.3. Очистка обжигового газа
- •8.4.4. Контактирование диоксида серы
- •8.4.5. Абсорбция триоксида серы
- •8.5.Производство серной кислоты из серы
- •8.5.1. Особенности технологического процесса
- •8.5.2. Сжигание серы
- •Производство серной кислоты из сероводорода
- •Охрана окружающей среды в производстве серной кислоты.
- •Охрана окружающей среды в химико-технологических процессах.
- •9.1. Процессы нефтепереработки
- •9.2. Металлургическое производство
- •9.2.1. Агломерационное производство
- •9.2.2. Доменное производство
- •9.2.3. Сталеплавильное производство
- •9.2.4. Литейное производство
- •9.2.5. Производство цветных металлов
- •9.3. Коксохимическое производство
- •Производство карбамида
- •Производство аммиачной селитры
- •9.6. Производство метанола
- •Производство формальдегида
- •9.8. Получение циклогексана гидрированием бензола
- •9.9. Производство этилбензола
- •9.10. Получение стирола
- •9.11. Производство дихлорэтана (дхэ)
6.Технология связанного азота
Под связанным азотом понимают азот, находящийся в виде различных соединений – аммиака, азотной кислоты и её солей, карбамида, аминов, аминокислот, белков и т.д.
Азот – одни из четырех элементов, без которых невозможно существование живой клетки. Соединения азота имеют исключительное значение для различных отраслей промышленности и сельского хозяйства. Их потребляют производства азотной кислоты, разнообразных минеральных удобрений, полимерных материалов, взрывчатых веществ и ракетных топлив, красителей, фармацевтических препаратов.
Основным природным источником азота является атмосфера. Масса азота в ней составляет 4∙1015 тонн, что соответствует 8∙104 тонн на каждый гектар суши. Однако, газообразный молекулярный азот представляет одно из самых устойчивых химических веществ. Энергия связи в молекуле азота равна 940,5 к Дж/моль. В расчете на атом азот обладает одной из самых высоких энтропий, именно поэтому элементарный азот нереакционноспособен. В естественных условиях лишь незначительное количество атмосферного азота переходит в биологически усвояемую форму в результате грозовых разрядов по реакции:
N2+O2=2NO,
или непосредственно фиксируется ограниченными видами растений в форме аминокислот в ходе фотосинтеза, катализируемого ферментами:
N2 (атм) → N (бакт)→ N (связан.).
Большинство организмов (высшие растения и животные) усваивают азот в виде его соединений со степенью окисления-3 и не могут использовать азот атмосферы. То же относится и к использованию соединений азота в промышленности.
Скорость перевода атмосферного азота в состояние, в котором он может быть усвоен или реализован, в природных процессах весьма мала. В среднем половина необходимого для жизни азота возвращается через атмосферу за 108 лет, тогда как для кислорода этот период составляет 3000 лет, а для углерода всего 100 лет. В то же время, организация современного культурного земледелия связана с непрерывным уносом «усвояемого» азота с посевных площадей, достигающим 88 млн. тонн в год, а это 90% азота, необходимого для питания растений. Поэтому первоочередная задача – непрерывное пополнение запасов азота в почве в усвояемой растениями форме, то есть в виде его соединений. До конца XIX столетия источником подобного «связанного» азота служили естественные удобрения и лишь в незначительной степени природные соли – нитраты натрия и калия, запасы которых в природе весьма ограничены. В Чили и Южной Африке имеются крупные запасы натриевой селитры, истощающиеся в результате интенсивной добычи.
Увеличение масштабов культурного земледелия и потребностей промышленности в разнообразных соединениях азота потребовали разработки промышленных способов получения этих соединений, то есть способов «связывания» атмосферного азота.
6.1.Методы связывания атмосферного азота
Высокая энтропия атома азота обусловила особый технологический режим проведения процессов с участием атмосферного азота: применение высоких температур, высоких давлений и специфических катализаторов. В начале XX века почти одновременно были разработаны три технических метода синтеза соединений из молекулярного азота: дуговой, цианамидный и аммиачный.
Дуговой метод основан на соединении азота с кислородом при высокой температуре (в пламени электрической дуги). В основе этого метода лежит эндотермическая обратимая реакция взаимодействия азота и кислорода, протекающая без изменения газового объёма:
N
 2+O2
2NO+∆H, где:
∆H=179,2 кДж,
2+O2
2NO+∆H, где:
∆H=179,2 кДж,
c последующим доокислением оксида азота (II) и получением нитрата кальция:
NO+Ca(OH)2+O2 → Ca(NO3)2.
Высокая инертность азота приводит к тому, что эта реакция с заметной скоростью начинает протекать лишь при очень высоких температурах (более 1500 К). При повышении температуры одновременно увеличивается и выход оксида азота (II). При температуре электрической дуги (а именно при этой температуре скорость синтеза становится приемлемой для практического применения) выход NO тем не менее достигает лишь нескольких процентов. Поэтому дуговой метод, являясь слишком энергоемким, не нашел большого практического применения.
В настоящее время этот метод начинает возрождаться на основе применения плазменных процессов.
Цианамидный метод основан на способности тонкоизмельченного карбида кальция при температуре около 10000С взаимодействовать с азотом по уравнению
CaC2+N2=CaCN2+C -∆H, где: ∆H = 300 кДж,
с последующим превращением кальцийцианамида в аммиак:
CaCN2+3H2O=2NH3+CaCO3.
Образование цианамида кальция протекает через цианид, который разлагается по схеме
Ca(CN)2→CaCN2+C
Процесс синтеза CaCN2 любопытен тем, что он автокаталитичен-наличие цианамида кальция ускоряет процесс его получения и позволяет снизить температуру процесса. Примерно так же, как CaCN2, действуют CaF2 и CaCℓ2 .
Для азотирования карбида кальция применяют преимущественно периодические ретортные печи. Высокая энергоемкость процесса и общая отсталость производства привели к тому, что теперь доля выпуска связанного азота цианамидным методом весьма незначительна.
Аммиачный метод, в основе которого лежит реакция взаимодействия азота и водорода:
N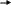 2+3H2
2NH3 - ∆H, где ∆H = 111,6 к Дж.
2+3H2
2NH3 - ∆H, где ∆H = 111,6 к Дж.
Сравнительная энергоемкость этих методов фиксации азота приведена в табл. 6.1.
Таблица 6.1.
Энергоемкость методов фиксации азота
-
Метод
Затраты энергии на производство
1 т аммиака, к Дж
Дуговой
7∙104
Цианамидный
1,2∙104
Аммиачный
0,5∙104
Энергетически и наиболее выгоден аммиачный метод фиксации, что и обусловило его широкое промышленное внедрение.
Первый завод по производству синтетического аммиака был построен в 1913 г., и за короткий период (15-20 лет) аммиачный метод практически полностью вытеснил все остальные способы.
Мировое производство синтетического аммиака постоянно увеличивается.
Таким образом, вследствие разработки и внедрения промышленных методов фиксации атмосферного азота, биохимический цикл азота, характеризуемый кругооборотом его по схеме:
растения→животные→поступление в почву продуктов жизнедеятельности и отмирания растений и животных→биохимические процессы разложения→захват растениями усвояемых форм азота
превращается в технобиогеохимический цикл, в котором преобладающее значение имеет техносфера.
Новым направлением в фиксации атмосферного азота является так называемый ферментативный метод с использованием комплексных соединений переходных металлов (железа, хрома, молибдена), в котором используется принцип естественной фиксации азота растениями в природных условиях:
2Ф-Me+N2→2Ф-MeN,
2Ф-Me+H2→2Ф-MeH,
Ф-MeN+3Ф-MeH→NH3+4Ф-Me,
где: Ф-Me- комплексное соединение металла и фермента.
Процесс протекает в условиях, близких к природным, при нормальном давлении и температуре 200С. Тем самым, промышленность подходит к реализации идеи Д.И.Менделеева, высказанной им в 1867 году о том, что:
“Может быть недалеко то время, когда найдется прием, позволяющий вводить в землю те условия или те вещества, которые заставят недеятельный азот воздуха превратиться в ассимилируемый аммиак и азотную кислоту”.
