
- •Лабораторная работа № 2 Определение интегральной теплоты растворения соли
- •Калориметрическая установка
- •1. Определение постоянной калориметра
- •Значения удельной теплоемкости для некоторых веществ
- •Порядок проведения опыта
- •3. Определение изменения температуры (t)
- •4. Вычисления
- •5. Определение теплоты растворения неизвестной соли
- •Порядок проведения опыта
- •Лабораторная работа № 9 каталитическое разложение перекиси водорода на платиновом катализаторе в присутствии различных сред
- •Лабораторная работа № 16 Определение электропроводности слабых электролитов
- •Экспериментальная часть
- •1. Методика измерений
- •2. Определение постоянной сосуда
- •3. Измерение электропроводности слабого электролита
- •Работа № 20 Электрохимические цепи
- •Электрод Раствор
3. Измерение электропроводности слабого электролита
Измеряют электропроводности растворов уксусной кислоты (или другой, предложенной преподавателем) следующих концентраций: 0,001 н, 0,01 н, 0,1 н, 1 н.
Начинают измерения в растворе меньшей концентрации. Электроды и сосуд перед началом измерений необходимо ополоснуть сначала дистиллированной водой, а затем определяемым раствором. Объем кислоты в сосуде должен быть таким же, каким был объем раствора хлорида калия.
Зная сопротивление раствора и постоянную сосуда - С0, находят удельную электропроводность данного раствора по формуле:
æ
х =
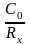 ,
Ом-1 . см-1
.
,
Ом-1 . см-1
.
По
формуле
=
æ
 находят эквивалентную электропроводность.
Затем по таблицам определяют
,
как сумму подвижностей катиона и аниона.
находят эквивалентную электропроводность.
Затем по таблицам определяют
,
как сумму подвижностей катиона и аниона.
По формуле определяют степень электролитической диссоциации.
Рассчитать значение , как сумму подвижностей катиона и аниона, взяв значения из таблицы в лаборатории.
По
формулам
или


проверяют закон разведения Оствальда.
Таблица 2
Экспериментальные и расчетные данные
№ |
Конц. раствора |
Rм |
Плечи реохорда |
Rх |
æ |
|
|
К |
|
а |
б |
||||||||
1
|
0,001 н |
1) 2) 3)
|
|
|
Rх ср |
|
|
|
|
2
|
0,01 н |
|
|
|
|
|
|
|
|
3
|
0,1 н |
|
|
|
|
|
|
|
|
4
|
1 н |
|
|
|
|
|
|
|
|
1. Теория электролитической диссоциации С. Аррениуса. Закон разведения Оствальда, его физический смысл.
2. Электропроводность слабых электролитов, удельная и эквивалентная, зависимость их от концентрации и температуры.
3. Экспериментальные методы определения электропроводности электролитов (схема установки, электроды, ток). Постоянная сосуда, физический смысл и метод определения.
4. Определение электропроводности при бесконечном разведении для слабых электролитов. Формула Кольрауша.
5. От чего зависят удельная и эквивалентная электропроводности сильных электролитов? Подвижности ионов и закон Кольрауша.
Зависимость подвижностей и электропроводности от концентрации в рамках теории Дебая-Гюккеля-Онзагера. Физический смысл электрофоретического и релаксационного эффектов. Эффекты Вина и Дебая-Фалькенгагена.
6. Способы определения электропроводности при бесконечном разведении для слабых и сильных электролитов.
Вопросы к работе:
Теория электролитической диссоциации.
Закон разведения Оствальда, физический смысл.
Электропроводность электролитов - эквивалентная и удельная. Зависимость удельной электропроводности от концентрации для слабых и сильных электролитов.
Формула Кольрауша для эквивалентной электропроводности при бесконечном разведении.
Скорость движения ионов, абсолютная скорость, подвижность. Аномальная подвижность ионов гидроксония и гидроксила в водных растворах, причины.
