- •Лабораторная работа № 2 Определение интегральной теплоты растворения соли
- •Калориметрическая установка
- •1. Определение постоянной калориметра
- •Значения удельной теплоемкости для некоторых веществ
- •Порядок проведения опыта
- •3. Определение изменения температуры (t)
- •4. Вычисления
- •5. Определение теплоты растворения неизвестной соли
- •Порядок проведения опыта
- •Лабораторная работа № 9 каталитическое разложение перекиси водорода на платиновом катализаторе в присутствии различных сред
- •Лабораторная работа № 16 Определение электропроводности слабых электролитов
- •Экспериментальная часть
- •1. Методика измерений
- •2. Определение постоянной сосуда
- •3. Измерение электропроводности слабого электролита
- •Работа № 20 Электрохимические цепи
- •Электрод Раствор
Лабораторная работа № 2 Определение интегральной теплоты растворения соли
Задачу калориметрии составляет измерение количества тепла, выделяющегося или поглощающегося при различных физико-химических процессах. Но теплота процесса не всегда является характеристикой для данного процесса, т.к., согласно первому закону термодинамики, она зависит не только от начального и конечного состояния системы, но и от пути перехода системы из одного состояния системы в другое.
Если ограничиться такими процессами, при которых единственным видом работы может быть работа против внешнего давления, то теплота процесса будет характерной величиной процесса при двух условиях: для изохорических процессов, где тепловой эффект равен изменению внутренней энергии:
QV = U2 - U1 = U
Для изобарных процессов, где тепловой эффект равен убыли энтальпии системы:
QP = H1 - H2 = H
При растворении в воде наблюдается либо поглощение, либо выделение тепла. Изучением тепловых процессов, сопровождающихся изменением состояния системы, занимается термохимия. По закону Гесса тепловой эффект реакции зависит только от начального и конечного состояния реагирующих веществ и не зависит от пути перехода от одного состояния к другому.
Пользуясь этим законом можно рассчитать тепловой эффект процесса там, где невозможно произвести точное прямое измерение.
При растворении вещества в воде протекают одновременно следующие процессы:
1. Разрушение кристаллической решетки вещества. При этом происходит поглощение тепла в количестве равном Q кристаллической решетки.
2. Гидратация ионов, сопровождаемая выделением опреде ленного количества тепла, равного Q гидратации. Теплота растворения соли равна алгебраической сумме тепловых эффектов этих процессов:
Q раств = Q крист.реш. + Q гидр
Вещества, обладающие прочной кристаллической решеткой и слабо гидратирующиеся в растворе, будут растворяться с поглощением тепла. Вещества с непрочной кристаллической решеткой или образующие в растворе сильно гидратированные ионы, например ионы водорода или гидроксила, будут растворяться с выделением тепла.
Теплота растворения, помимо природы растворенного вещества и растворителя, зависит от температуры растворителя и концентрации полученного раствора.
Различают интегральную и дифференциальную теплоты растворения.
Интегральная теплота растворения – это тепловой эффект растворения одного грамма (удельная) и одного моля (мольная) вещества в определенном количестве растворителя, при данной температуре.
Дифференциальная или парциальная теплота растворения – это тепловой эффект, сопровождающий процесс растворения одного моля или одного грамма вещества в настолько большом количестве растворителя определенной концентрации, что изменение ее, вызванное растворением этого количества вещества, можно считать равным нулю.
Интегральные теплоты растворения находятся экспериментально, а дифференциальные – методом расчета.
Калориметрическая установка
Большинство калориметрических измерений сводятся к тому, что процесс проводят в калориметре и наблюдают вызванное этим процессом температуры калориметра.
Простейший калориметр с изотермической оболочкой изображен на рис.1. Тефлоновый нетеплопроводный стакан(4) вставлен в оболочку (8) на подставке из материала с малой теплопроводностью. Для уменьшения испарения калориметрической жидкости и для придания всей установке в собранном виде механической жесткости, стакан закрывают крышкой (3).
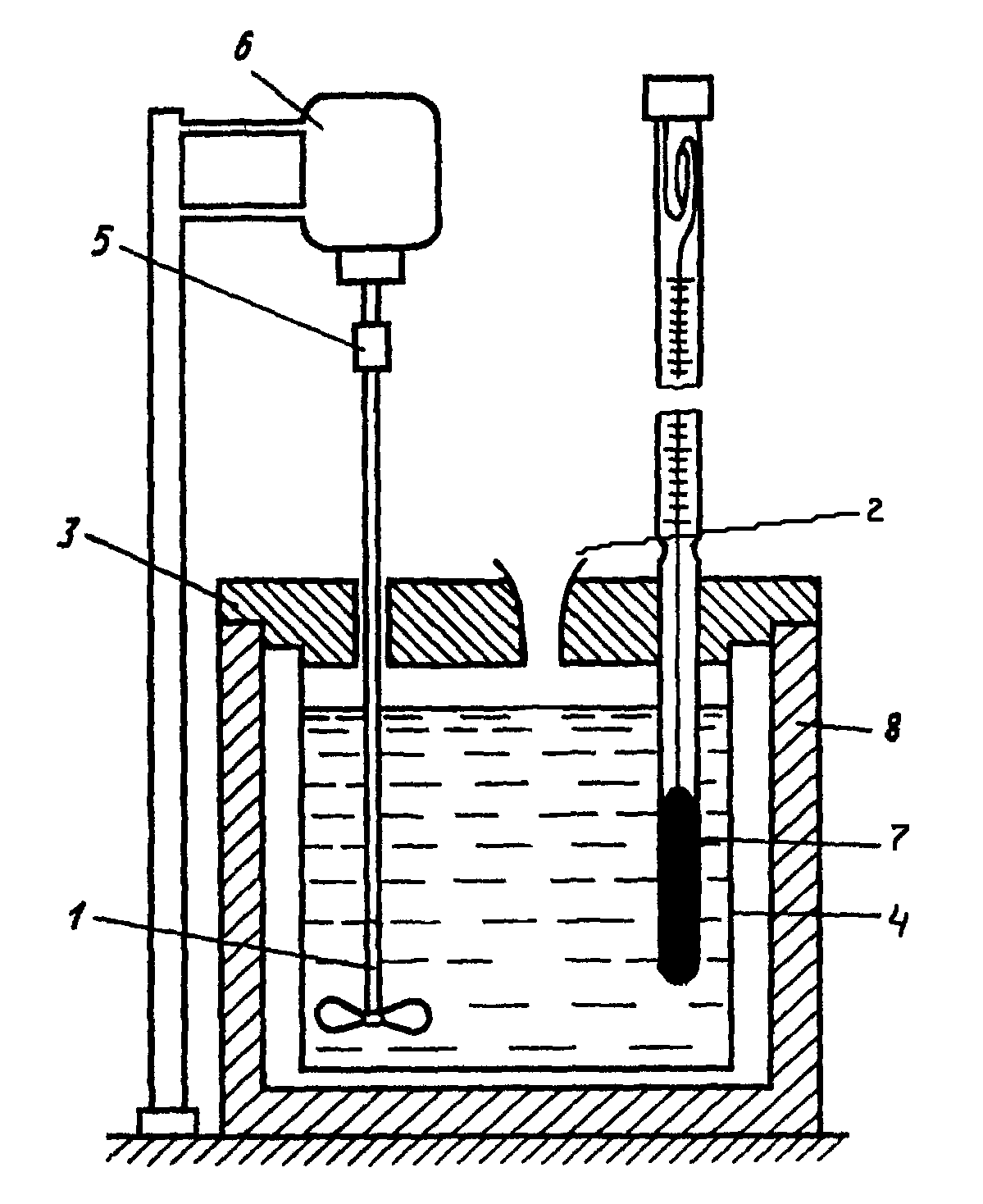
Рис.1. Калориметрическая установка:
1 – мешалка, 2 – воронка для ввода вещества, 3 – крышка,
4 – внутренний стакан, 5 – муфта, 6 – электромотор,
7 – термометр Бекмана, 8 – внешний стакан.
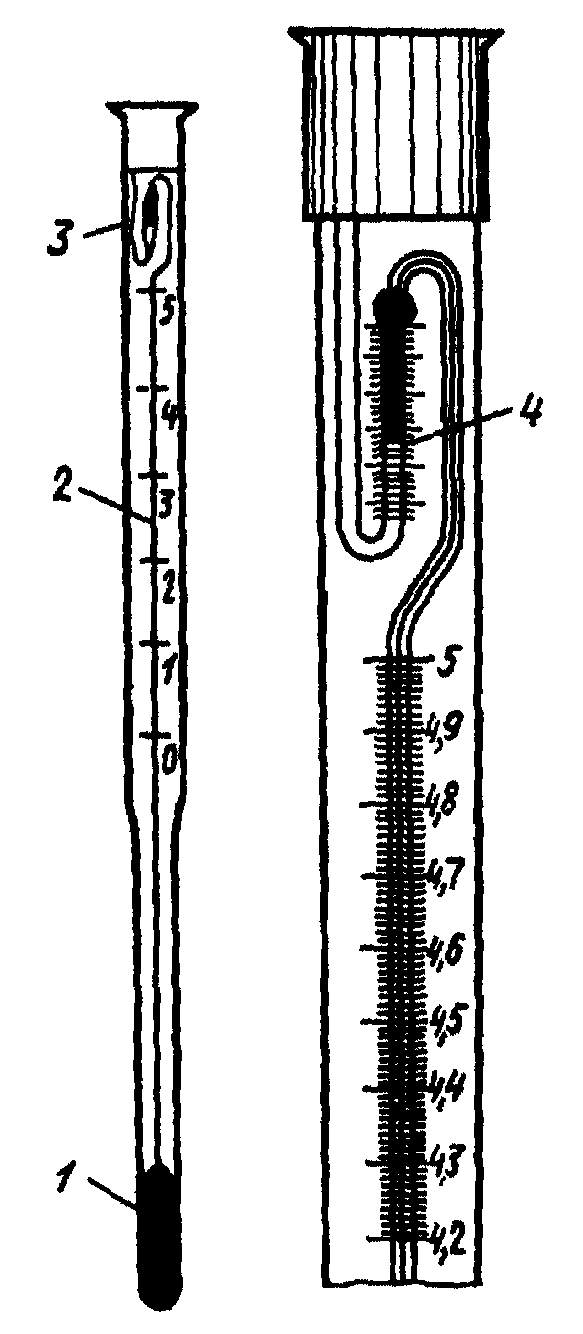
В крышке сделаны отверстия для мешалки, термометра и для ввода соли (2). Для быстрого установления теплового равновесия между всеми частями калориметрической установки и для энергичного смешивания исследуемых веществ используют мешалку (1), приводимую в движение электрическим мотором (6). Изменение температур и хода опыта определяют с помощью термометра Бекмана (7). Вся шкала его охватывает интервал температур в 50 С.
Цена наименьшего деления – 0,010С. (Рис.2)
|
1 – нижний резервуар большого объема для ртути, 2 – капилляр и измерительная шкала, 3 – верхний запасной резервуар, 4 – шкала верхнего резервуара для грубой настройки термометра.
|
Рис.2. Метастатический термометр Бекмана: |
|
Количество ртути в основном резервуаре А можно изменять путем перевода ртути в трубку В и обратно. Это дает возможность работать с термометром Бекмана при температурах от –90 до +2000С.
Таким образом, следует помнить, что шкала такого термометра имеет условный характер.