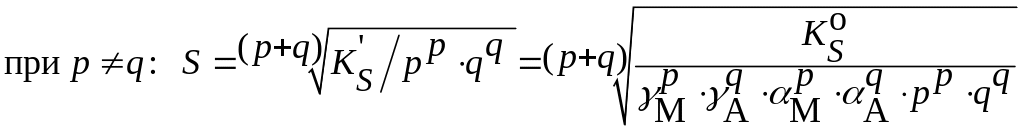- •3.3.2. Растворимость осадка с учетом влияния ионной силы раствора. Солевой эффект
- •3.3.3 Влияние конкурирующих равновесий протонирования и комплексообразования на растворимость осадков
- •3.3.3.1 Условное произведение растворимости
- •3.3.3.2 Растворимость осадков под действием сильных кислот (при заданном значении рН раствора)
- •3.3.3.3 Влияние диссоциации воды на растворимость осадков
- •3.3.3.4 Влияние конкурирующих процессов комплексообразования на растворимость осадков
3.3.3.4 Влияние конкурирующих процессов комплексообразования на растворимость осадков
Теперь рассмотрим растворимость осадка при протекании сопряженных реакций комплексообразования, то есть, если αM < 1 и αA = 1.
Если катион осадка в растворе образует с комплексантом L комплексные соединения составов MLi (i = 1…n), то значение мольной доли свободных катионов, не связанных в комплекс, рассчитывают по уравнению:
 (3.24)
(3.24)
Здесь:
![]() –
суммарная
равновесная концентрация всех форм
катиона, которая слагается из равновесных
концентраций всех его не закомплексованных
и закомплексованных форм;
–
суммарная
равновесная концентрация всех форм
катиона, которая слагается из равновесных
концентраций всех его не закомплексованных
и закомплексованных форм;
n– максимальное координационное число иона M в соединениях MLi.
Выразим равновесные концентрации частиц [MLi] через общие константы
устойчивости (образования) комплексов MLi и равновесную концентрацию
комплексанта [L]:
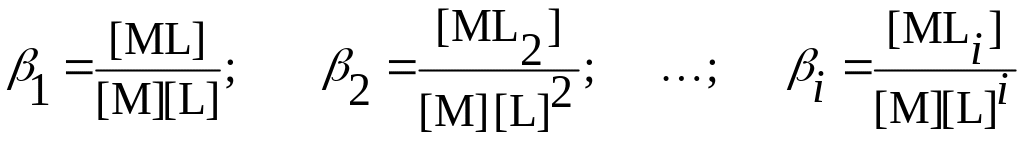
Откуда:
![]()
Подставив полученные значения [MLi] в уравнение (3.24), получим:
 (3.25)
(3.25)
Для
практических расчетов удобнее пользоваться
не выражением
![]() ,
а обратной величиной –
,
а обратной величиной –
![]() ,
которую называют функцией
закомплексованности
и рассчитывают по формуле:
,
которую называют функцией
закомплексованности
и рассчитывают по формуле:
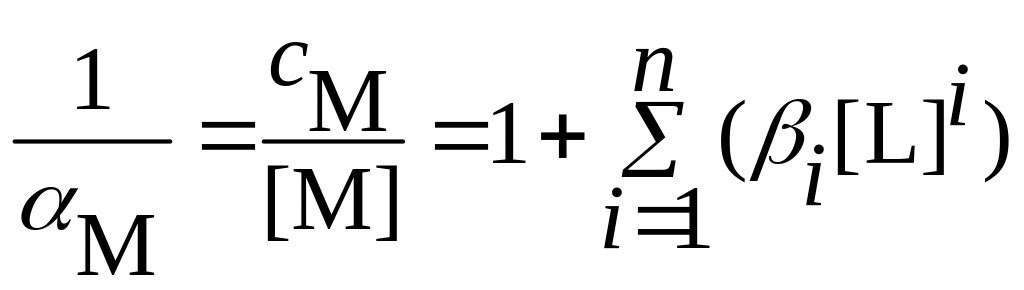 (3.26)
(3.26)
При рассмотрении влияния комплексообразования на растворимость осадка малорастворимого соединения могут встретиться следующие варианты:
Растворимость осадка при образовании комплексов с посторонними
лигандами.
Пример: Вычислить растворимость AgCl в воде и в 0.01 М растворе NH3
![]() ;
Все
значения констант здесь и далее берут
из справочных данных, например в [7,8
].
;
Все
значения констант здесь и далее берут
из справочных данных, например в [7,8
].
Решение: В насыщенном водном растворе:
![]()
В
водном растворе
![]() :
:

 ;
;
![]()
Растворимость возросла в примерно 40 раз.
Растворимость осадка при образовании комплексов с избытком осадителя
Пример:
Вычислить растворимость AgCl при![]()
![]()
Решение. В насыщенном водном растворе:
В растворе, содержащем избыток хлорид – ионов при :

откуда:

Экспериментально же установлено, что при высоких концентрациях хлорид – ионов растворимость осадка увеличивается во много раз больше расчетного значения, что обусловлено недостаточной информацией о составе комплексов и их константах устойчивости.
Растворимость осадка в буферном растворе, содержащем как посторонний ион – комплексант так и одноименный ион, служащий комплексантом
Пример:
Вычислить растворимость хлорида серебра
![]() в буферном растворе с
в буферном растворе с
![]() и
и
![]() .
Образованием хлоридных комплексов
пренебречь.
.
Образованием хлоридных комплексов
пренебречь.
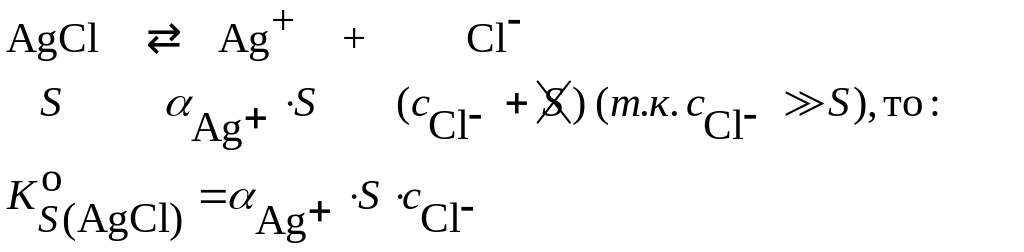

٭Для
хлоридных комплексов при
![]()
 .
.
В заключение следует напомнить соотношения между термодинамическим, концентрационным (реальным) и условным произведениями растворимости и расчетными формулами растворимости:
для идеальной системы: в случае сильно разбавленных растворов
(с < 1·10–4
моль·л−1)
и при
![]()
![]()
![]()
для реальных систем:
а) в присутствии посторонних электролитов:
![]()


б) при наличии конкурирующих равновесий протонирования и комплексообразования и в отсутствие посторонних электролитов:
![]()
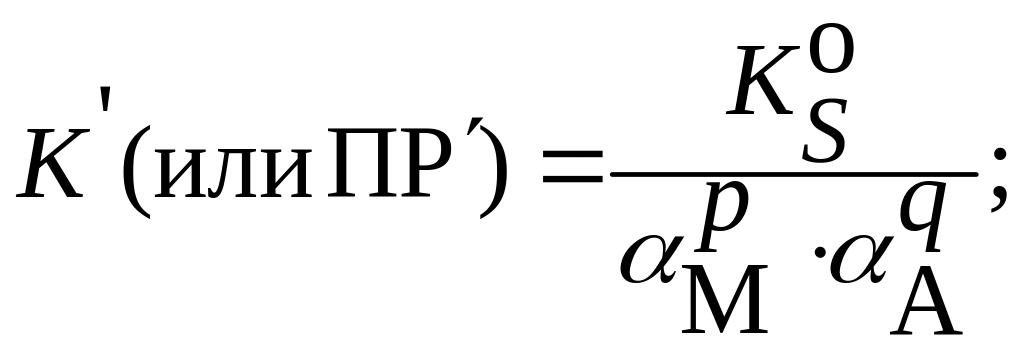

в) при наличии конкурирующих равновесий протонирования и комплексообразования и в присутствии посторонних электролитов:
![]()