
- •Відповідальний
- •Техніка безпеки в хімічній лабораторії
- •Правила оформлення звiту з лабораторної роботи
- •Стислі теоретичні відомості
- •Стислі теоретичні відомості
- •Лабораторна робота 2 дослідження фізико-хімічних властивостей стічних вод. Очищення стічної води методом адсорбції на твердих адсорбентах
- •Стислі теоретичні відомості
- •Лабораторна робота 3 освітлення стічної води методом коагуляції електролітами
- •Стислі теоретичні відомості
- •Лабораторна робота 4 експрес-метод визначення кислотності опадів
- •Стислі теоретичні відомості
- •Лабораторна робота 5 знезараження питних та стічних вод методом електролізу
- •Стислі теоретичні відомості
- •Список літератури
Лабораторна робота 3 освітлення стічної води методом коагуляції електролітами
Мета роботи: дослідити фізико-хімічні властивості стічних та забруднених вод; провести освітлення стічних вод методом коагуляції електролітами; порівняти характеристики забрудненої та освітленої проб води. Зробити висновки щодо якості досліджуваної стічної води та ефективності її освітлення.
Дослід 1. Органолептичне дослідження проби стічної води
Завдання: відібрати проби стічної води (див. попередні лабораторні роботи). Визначити її органолептичні характеристики за наведеними методиками (див. лабораторну роботу 1): температуру, запах, наявність завислих речовин (грубодисперсних домішок), колірності води, прозорості води) "за шрифтом" чи "за хрестом").
Дослід 2. Освітлення стічної води за допомогою коагуляції електролітами
Стислі теоретичні відомості
За розміром домішки, що містяться у воді, можна класифікувати таким чином:
1. Речовини, які знаходяться в грубодисперсному стані. Розмір частинок цих речовин 10-3 − 10-4 см. Це частинки глини, піску, планктон, залишки мертвої рослинності. Частинки цих речовин утворюють з водою суспензію, перебувають у воді у суспендованому завислому стані і можуть бути видалені при відстоюванні в відстойних баках та при фільтруванні води крізь шар піску, гравію, коксу.
2. Речовини, які перебувають у колоїдно-дисперсному стані.
Колоїдні частинки − це угруповання десятків та сотен молекул. Розміри цих угруповань 10-5 − 10-7 см. У колоїдно-дисперсному стані у воді містяться продукти розкладу тваринних та рослинних організмів. Колоїдні частинки мають певний електричний заряд. Виникнення заряду зумовлено адсорбцією на поверхні частинок дисперсної фази іонів електролітів, що знаходяться у дисперсійному середовищі, або іонізацією молекул дисперсної фази.
Колоїдні частинки, маючи однаковий заряд, при зближенні відштовхуються одна від одної і не можуть укрупнюватись. Стійкість колоїдних розчинів може бути порушена в результаті нейтралізації електричного заряду частинок дисперсної фази, яка може бути досягнута при введенні в колоїдну систему, наприклад, електролітів.
Будова колоїдної міцели. Теорія подвійного електричного шару Штерна дозволила пояснити будову частинок дисперсної фази колоїдної системи. Золь складається з міцел та інтерміцелярної рідини.
Міцела − це структурна колоїдна одиниця, інтерміцелярна рідина − дисперсійне середовище, що розділяє міцели і містить електроліти, неелектроліти і поверхнево-активні речовини (ПАР). Тверда фаза (див. рис.), яка міститься всередині міцели, називається агрегатом, агрегат з потенціалвизначальними іонами − ядром міцели. Ядро разом з адсорбційним шаром утворює частинку або гранулу, яка оточена дифузним шаром.
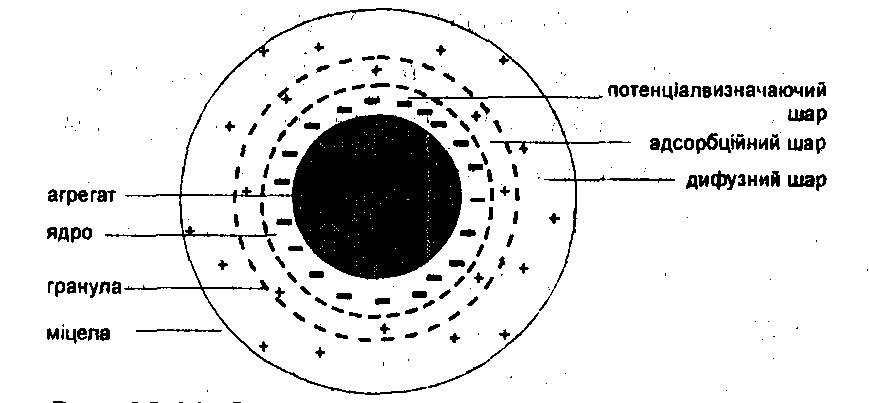
Рис. Схема будови міцели
Н![]()
 априклад,
склад міцели йодиду аргентуму, утвореного
при надлишку йодиду калію, можна виразити
за допомогою формули:
априклад,
склад міцели йодиду аргентуму, утвореного
при надлишку йодиду калію, можна виразити
за допомогою формули:
де т − число молекул йодиду аргентуму; n − число потенціалвизначальних іонів йоду; (n − х) − число іонів калію в адсорбційному шарі; х − число іонів калію в дифузному шарі.
Потенціалвизначальними іонами, за правилом Панета − Фаянса, є іони йоду, бо вони добудовують кристалічну решітку AgI і тому, саме вони, а не іони калію утворюють потенціалвизначальний шар. Заряд гранули х зумовлений надлишком іонів йоду у кількості х порівняно з числом іонів калію. Міцела електронейтральна, тому у дифузному шарі міститься х іонів калію.
Якщо потенціалвизначальний іон дво- або тризарядний, то число однозарядних адсорбційних протиіонів буде 2(n − х) або 3(n − x) і заряд гранули дорівнюватиме 2х або 3х з відповідним знаком. Наприклад, формула міцели Fе(ОН)3, якщо електролітом-стабілізатором є FеСІ3, записується таким чином:
![]()
Коагуляцією називають зменшення дисперсності системи в результаті злипання частинок дисперсної фази. Коагуляція може відбуватися внаслідок старіння системи, зливанні різних колоїдів, частинки яких мають протилежні знаки, у випадку зміни температури, механічної дії, дії електромагнітного поля та ін. Однак найбільш важливе теоретичне і практичне значення має коагуляція під дією електролітів.
Іони електроліту, що вводять, нейтралізують заряди протилежного знака, які знаходяться на поверхні колоїдної частинки. В результаті зменшення або повної нейтралізації зарядів колоїдні частинки укрупнюються, злипаються (коагулюють). Під дією сили тяжіння укрупнені частинки дисперсної фази осаджуються − відбувається седиментація.
Отже, за допомогою коагуляції можна осадити домішки, що перебувають у колоїдно-дисперсному стані у воді. Так, колоїдні частинки органічного походження, що містяться у воді, зазвичай несуть негативний заряд за рахунок адсорбції негативних іонів. Цей заряд нейтралізують, додаючи спеціальні речовини-електроліти − коагулянти.
Як коагулянти використовують солі алюмінію та феруму (ІІІ), наприклад, Al2(SO4)3; FeCl3. При розчиненні у воді цих солей, утворених сильними кислотами та слабкими основами, вони підлягають гідролізу. Наприклад:
A l3+
+ H2O
AlOH2+
+ H+
;
l3+
+ H2O
AlOH2+
+ H+
;
A lOH2+ + H2O Al(OH)2+ + H+ ;
A l(OH)2+ + H2O Al(OH)3 + H+ ;
A l2(SO4)3 + 2 H2O 2Al(OH)SO4 + H2SO4 ;
2 Al(OH)SO4 + 2H2O [Al(OH)2]2SO4 + H2SO4 ;
Встановлено такі закономірності коагуляції електролітами (правила коагуляції):
1. Коагуляцію викликають будь-які електроліти, але з помітною швидкістю вона починається при досягненні певної концентрації. Мінімальна концентрація електроліту, при перевищенні якої спостерігається коагуляція, називається порогом коагуляції. Поріг коагуляції γ виражають у ммоль/л.
Величину, зворотну порогу коагуляції, називають коагулюючою здатністю. Коагулююча здатність Vк — це об’єм золю, скоагульованого 1 моль електроліту. Початок коагуляції можна визначити за різними ознаками: за зміною забарвлення золю, виникненням каламуті, початком виділення осаду і т. д. Завжди необхідно вказувати умови, за яких визначений поріг коагуляції.
2. Коагулюючу дію має лише той іон електроліту, заряд якого протилежний заряду колоїдної частинки. Коагулююча здатність іона тим більша, чим більший його заряд. Ця залежність називається правилом Шульце-Гарді. Прямо пропорціональної залежності між зарядом іона і його коагулюючою здатністю немає; коагулююча здатність зростає набагато швидше, ніж заряд.
За емпіричним правилом Шульце-Гарді поріг коагуляції визначається в основному валентністю противоіонів: співвідношення порогів коагуляції одно-, двух- і тривалентних противоіонів приблизно становить 1:0,016:0,0013 (відповідно відношення зворотних величин − здатності до коагулювання становить 1:60:700).
3. У неорганічних іонів з однаковим зарядом коагулююча дія зростає із зменшенням ступеня гідратації. Наприклад, в ряду одновалентних катіонів і аніонів коагулююча активність і гідратація змінюються таким чином:
зростання коагулюючої активності зростання коагулюючої активності
Li+ Na+ K+ Rb+ Cl- Br- I- CNS-
зростання ступеня гідратації зростання ступеня гідратації
Такі ряди, в яких іони однакового заряду розташовуються за зменшенням ступеня гідратації, називаються ліотропними. Ступінь гідратації зменшується, а коагулююча дія збільшується із зростанням радіуса іона.
4. Коагулююча дія органічних іонів зростає з підвищенням адсорбційної здатності.
5. В осаді, утвореному при коагуляції, завжди присутні іони, які її викликали.
При коагуляції сумішами електролітів спостерігаються три ефекти: адитивність дії, антагонізм і синергізм електролітів.
Адитивність полягає в тому, що кожний електроліт діє незалежно. При антагонізмі електролітів вони ніби протидіють один одному, і для коагуляції золю їх потрібно більше, ніж у випадку адитивності дії електролітів. Синергізмом називають посилення коагулюючої дії одного електроліту при додаванні іншого. В цьому випадку для коагуляції їх треба додати менше, ніж у випадку їх адитивної дії.
Адитивність спостерігається у іонів однакового заряду і близьких за властивостями (наприклад, К+ і Na+, Сl- і Br-). Прикладом антагонізму може бути коагуляція золю AgI сумішами Al(NO3)з і K2SO4, Th(NO3)4 і Na2SO4. Синергізм виявляється, наприклад, при дії суміші LiCl і СаСl2 на золь HgS.
Якщо до золю додавати електроліт невеликими порціями, то коагуляція настає при більшій концентрації електроліту, ніж при одноразовому його додаванні. Це явище називається звиканням золю. Причиною звикання золю може бути повільна адсорбція іонів, заряджених однойменне з частинкою, яка призводить до збільшення заряду останньої.
При додаванні до ліофобних золів високомолекулярних речовин стійкість їх значно підвищується. Це явище називається колоїдним захистом. Механізм захисної дії полягає в утворенні адсорбційного шару з високомолекулярної речовини. Захисний шар забезпечує сольватацію частинки, сольватні шари створюють великий розклинюючий тиск і перешкоджають злипанню частинок. Захисна дія підсилюється при утворенні в дисперсійному середовищі достатньо міцної об'ємної структури. Найбільшу захисну дію чинять білки (желатин, казеїнат натрію, альбумін), менше вона виражена у крохмалю, декстрину.
Якщо кількість високомолекулярної речовини, доданої до золю, дуже мала, то можливе не підвищення, а зниження стійкості. Це явище одержало назву сенсибілізації. Сенсибілізацію можна пояснити нейтралізацією поверхневого заряду частинки протилежно зарядженим макроіоном або одночасною адсорбцією макроіона на кількох частинках, при цьому молекула, наприклад білка, як місток зв’язує їх.
Іони електроліту, що вводять, нейтралізують заряди протилежного знака, які знаходяться на поверхні колоїдної частинки. В результаті зменшення або повної нейтралізації зарядів колоїдні частинки укрупнюються за рахунок злипання. Це явище називають коагуляцією. Під дією сили тяжіння укрупнені частинки дисперсної фази осаджуються − відбувається седиментація. Коагуляція може проходити і при підвищенні температури, механічному та електричному впливі на систему, а також внаслідок її старіння. Коагуляцію можна викликати, якщо злити разом колоїдні розчини, частинки яких мають різні за знаком заряди.
Завдання: Після попереднього визначення прозорості проби стічної води "за шрифтом" чи "за хрестом" провести її освітлення за допомогою таких коагулянтів: 10 %-го розчину хлориду натрію; 20 %-го розчину хлориду натрію; 10 %-го розчину сульфату алюмінію; 10 %-го розчину сульфату феруму (ІІІ). Після цього визначити прозорість освітленої води "за хрестом" та "за шрифтом". Зробити висновки.
