
- •Строение алканов
- •Реакционная способность алканов. Реакции замещения атомов водорода в алканах.
- •Реакция Дюма
- •2.Синтез из иодистых алкилов
- •Строение алкенов
- •3. Виды изомерии
- •Реакционная способность алкенов
- •II. Реакции окисления
- •1. Окисление (гидроксилирование-введение двух гидроксильных групп) в в нейтральной среде без нагревания (реакция Вагнера).
- •2.Окисление в жестких условиях
- •2. Препаративные (лабораторные) способы получения
- •II. Реакции замещения с участием терминального атома водорода.
- •III. Реакции окисления.
- •Методы получения алкинов
- •1.Синтез ацетилена
- •Сопряженные диены
- •Строение сопряженных диенов
- •4. Гидрогалоидирование, (АdE)
- •Циклоалканы
- •Циклопропан
- •Электронное строение циклопропана
- •Циклобутан
- •Циклопентан
Сопряженные диены
Углеводороды, имеющие две двойные связи, разделенные простой связью относятся к сопряженным диенам.
Номенклатура, суффикс диен

Строение сопряженных диенов
В молекулах сопряженных диенов реализуется взаимодействие π-связей, которое называется сопряжением, при этом электронная плотность р-электронов π-связей делокализуется (перераспределяется). В результате сопряжения наблюдается дополнительное перекрывание р-орбиталей между С2 – С3, что хорошо видно на рисунке.
Изображение молекулы бутадиена – 1,3 (вид «сверху») (р–орбитали – в виде окружностей):
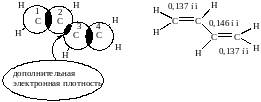
Следствием делокализации электронной плотности является то, что длины связей С1 – С2 (С3 – С4) увеличены, по сравнению с длиной двойной связи в этилене (0,132 нм) и составляют 0,137 нм; в свою очередь, длина связи С3 – С4 меньше, чем в этане С – С (0,154 нм) и составляет 0,146 нм.
Выигрыш энергии за счёт делокализации – энергия сопряжения, в случае бутадиена – 1,3 составляет 15 кДж/моль, т.е. сопряженные системы энергетически выгодны. Алкены практически отсутствуют в природе, высокомолекулярные сопряженные диены представлены в природе, к ним относятся каротин и ликопин (соединения, придающие оранжевый и красный цвета фруктам и овощам), сквален (окрашивает в желтый цвет печень акулы), витамины А и Е.
Для сопряженных диенов характерны реакции электрофильного присоединения AdE; следствием сопряжения и образования единой электронной системы является возможность образования двух продуктов ракции по типу 1,2- и 1,4-присоединения, т.к. реагент может дополнительно атаковать диеновую систему по концевым атомам С.
Реакции электрофильного присоединения AdE
1. Присоединение водорода

Восстановление с помощью [Na + C2H5OH] называется восстановлением водородом в момент выделения. Алкены в таких условиях не восстанавливаются. Восстановление этим способом является отличительным свойством сопряженных диенов. При каталитическом гидрировании используют избыток водорода, и реакция идет с образованием алканов.
2. Присоединение 1 моля Br2, (АdE)
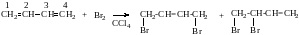
1,4 – дибромбутен – 2 3,4 – дибромбутен-1
1,4 – присоединение 1,2-присоединение
3. Присоединение избытка Br2, (АdE в два этапа)
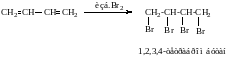
4. Гидрогалоидирование, (АdE)
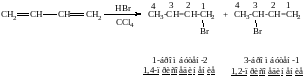
Методы синтеза диенов в данном пособии мы не рассматриваем.
Контрольные вопросы к главе «ДИЕНЫ»
1. Напишите структурные формулы соединений: а) пропадиена; б) 1,2-бутадиена; в) 1,3-бутадиена; г) 2-метил-1,3-бутадиена; д) 2,3-диметил-1,3-бутадиена; е) 1,5-гексадиена.
Отметьте диены с сопряженными С=С связями.
2. Назовите соединения:

3. Напишите реакции гексадиена-2,4 с указанными реагентами. Для случаев, отмеченных звездочками, приведите механизмы: а) Br2, CCl4, 20C; б) НBr, 20C; в) Н2 (изб.), Pt; г) КMnO4, H2O, t; д) Na+C2Н5OH.
Циклоалканы
Классификация:
- малые циклы С3-С4 циклопропан, циклобутан;
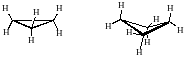
- обычные циклы С5-С6 циклопентан, циклогексан;
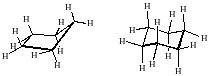
- средние циклы С7-С12 ;
- макроциклы >С12 .
В данном курсе даются лишь общие понятия о пространственном строении малых и обычных циклов.
