
- •Строение алканов
- •Реакционная способность алканов. Реакции замещения атомов водорода в алканах.
- •Реакция Дюма
- •2.Синтез из иодистых алкилов
- •Строение алкенов
- •3. Виды изомерии
- •Реакционная способность алкенов
- •II. Реакции окисления
- •1. Окисление (гидроксилирование-введение двух гидроксильных групп) в в нейтральной среде без нагревания (реакция Вагнера).
- •2.Окисление в жестких условиях
- •2. Препаративные (лабораторные) способы получения
- •II. Реакции замещения с участием терминального атома водорода.
- •III. Реакции окисления.
- •Методы получения алкинов
- •1.Синтез ацетилена
- •Сопряженные диены
- •Строение сопряженных диенов
- •4. Гидрогалоидирование, (АdE)
- •Циклоалканы
- •Циклопропан
- •Электронное строение циклопропана
- •Циклобутан
- •Циклопентан
II. Реакции окисления
1. Окисление (гидроксилирование-введение двух гидроксильных групп) в в нейтральной среде без нагревания (реакция Вагнера).
Условия реакции: KMnO4, H2O при t°C от 00° до 20°С.

2.Окисление в жестких условиях
Условия реакции: KMnO4 или K2Cr2O7 в присутствии конц. H2SO4 при нагревании.
При окислении в этих условиях происходит разрыв двойной связи с образованием кислот, кетонов или СО2 в зависимости от строения алкена. Эта реакция позволяет определить положение двойной связи и установить строение алкена.
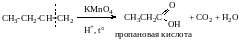


Методы получения алкенов
1. Дегидрирование (отщепление водорода) в условиях пиролиза, крегинга (промышленный способ получения).

2. Препаративные (лабораторные) способы получения
а) Дегидрогалогенирование моногалогенопроизводных с помощью спиртового раствора щелочи при нагревании (КОН, спирт, °t).

Реакции дегидрогалогенирования и дегидратации (см. ниже) относятся к реакциям элиминирования и подчиняются правилу Зайцева. По правилу Зайцева при наличии в исходном соединении более одного -положения (в -положении находится атом углерода, связанный с функциональной группой) в реакциях элиминирования образуются преимущественно наиболее замещенные при двойной связи алкены, как более стабильные .
б) Дегидратация спиртов действием конц. H2SO4 при 1800C, Al2O3 при 3500C.

Реакция дегидратации подчиняется правилу Зайцева.
Контрольные вопросы к главе «АЛКЕНЫ»
1. Напишите структурные формулы соединений: а) 3,4-диметил-3-гексен; б) 2,3,5-триметил-2-гексен; в) 2,2,5,5- тетраметил-3-гексен; г) 2-метил-3,4-диэтил-3-гексен.
2. Назовите следующие алкены:

3. Напишите структурные формулы всех изомерных алкенов состава С5Н10. Назовите их.
4. Сравните отношение к брому изобутана на свету и изобутена в CCl4. В чем причина различного протекания реакций? Приведите их механизмы.
5. Напишите реакции бутена-1 с указанными реагентами. Для случаев, отмеченных звездочками, приведите механизмы: а) Br2 (CCl4); б) Cl2 (CCl4); в*) HBr; г) HCl; д) HI; е) Н2О (H+).
6. В каком направлении преимущественно протекают реакции электрофильного присоединения? Предскажите главные продукты реакции:

7. Напишите продукты реакций окисления пентена-2 в следующих условиях: а) КMnO4 (H2O, 20 С); б) КMnO4 (H2SO4, t); в) K2Cr2O7 (H2SO4, t).
8. Как химическим путем можно отличить пары соединений: а) н-гексан и гексен-2; б) гексен-2 и гексен-3; в) 2-метилпентен-2 и 3-метилпентен-2?
9. Напишите уравнения реакций. Назовите исходные соединения и тип химического превращения.

10. Напишите уравнения реакций и назовите образующиеся продукты:

11. Какими реакциями и какие алкены можно получить, исходя из следующих соединений: а) (CH3)2CНCH2CH3; б) CH3СН2CH2CH2СН2OH; в) CH3СН2CСl(CH3)2.
12. Из каких спиртов и алкилгалогенидов можно получить 2-метилгексен-2? Приведите схемы реакций. Сформулируйте правило Зайцева.
13. Напишите уравнение всех последовательных реакций. Назовите все полученные углеводороды:

АЛКИНЫ
Номенклатура, суффикс ин

При названии соединений, имеющих двойную и тройную связи надо учитывать, что по номенклатуре IUPAC двойная связь старше тройной связи.
Строение алкинов
1. Атом углерода находится в sp-гибридизации.
2. Строение этина (ацетилена).


Длина связи С≡С 0,120 нм
Энергия связи С≡С 837 Кдж/моль
Молекула имеет цилиндрическую симметрию.
НС≡СН э.о. АТ.С SP3 2,5 э.о. АТ. Н 2,1
э.о. АТ.С SP2 2,8
э.о. АТ.С SP 3,1
В таблице приведены значения электроотрицательностей атомов С для различных вариантов гибридизации (Э.О.ат.С) и атома Н. Связи СSP–Н поляризованы сильнее, чем СSP2–Н и СSP3–Н, так как электроотрицательность СSP (3,1)выше, чем электроотрицательность СSP2 (2,8) и СSP3 (2,5). Ацетилен и алкилацетилены проявляют свойства СН-кислот, атомы водорода при тройной связи (терминальный) способны замещаться на атомы металлов.
3. Для алкинов характерны структурная изомерия углеводородного скелета (изомерия цепи) и изомерия положения тройной связи.
Основным направлением реакционной способности алкинов являются реакции присоединения по тройной связи (в один или два этапа), а также алкины вступают в реакции замещения терминальных атомов водорода.
Реакционная способность
I. Реакции присоединения
а) Галогенирование, (присоединение 1 моля реагента), AdE

б) Гидрогалогенирование, AdE

Присоединение 2-го моля НСl к молекуле хлористого винила происходит в соответствии с поляризацией молекулы исходного соединения, в которой имеется сопряженная система и реализуется мезомерный эффект. Сопряжение – это взаимодействие р-электронов рядом стоящих двойных связей (для сопряженных диенов и ароматических систем, см. соответствующие темы) или взаимодействие р-электронов неподеленных пар гетероатома (галогена, азота, кислорада) и двойной связи, находящихся рядом.
Исходя
из этого рассмотрим строение молекулы
хлористого винила. Одна из неподеленных
пар электронов (НПЭ) хлора донорно
взаимодействует
с  -связью,
что выражается в дополнительном
перекрывании их орбиталей, это приводит
к увеличению электронной плотности
свяи С-Сl
и поляризации молекулы – на атоме Сl
создается частичный положительный
заряд, а на концевом атоме С – частичный
отрицательный заряд, т.е. атом
Сl
является электронодонором при наличии
сопряженной системы. Аналогично будут
вести себя атомы N
и О. Для
описания поляризованных сопряженных
систем использется также понятие
мезомерного эффекта.
-связью,
что выражается в дополнительном
перекрывании их орбиталей, это приводит
к увеличению электронной плотности
свяи С-Сl
и поляризации молекулы – на атоме Сl
создается частичный положительный
заряд, а на концевом атоме С – частичный
отрицательный заряд, т.е. атом
Сl
является электронодонором при наличии
сопряженной системы. Аналогично будут
вести себя атомы N
и О. Для
описания поляризованных сопряженных
систем использется также понятие
мезомерного эффекта.
Мезомерного эффект – это передача электронного влияния заместителя по сопряженной системе связей. Заместителями в этом случае являются функциональные группы, находящиеся при двойной связи или системе двойных связей, как в диенах или ароматических соединениях.
Если заместитель является электронодонором, ему приписывается положительный мезомерный эффект +М. Таким эффектом обладают все атомы или группы атомов, содержащие элементы с НПЭ: галогены, гидроксил, алкоксигруппы (ОR), аминогруппы (NH2, NHR, NRR).
Электроноакцепторные группы - нитрогруппа (NO2), карбонильные (CHO и COR), карбоксил (COOH), сложноэфирная (COOR), нитрильная (CN), сульфогруппа (SO3H) обладают отрицательным мезомерный эффект –М, они поляризуют сопряженные системы со смещением электоронов в свою сторону. Системы, содержащие эти группы, будут рассмотрены в ароматических углеводородах.
С учетом выше сказанного хлор в молекуле хлористого винила является донором электоронов и проявляет +М.
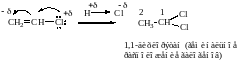
Аналогично будет описываться электоронодонорное влияние для ОН, ОR и NH2, NHR, NRR-групп в ниже приведенных сопряженных системах.

Химизм присоединения НBr к пропину приведен ниже:
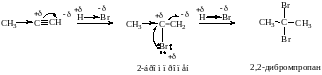
в) Гидратация (реакция Кучерова).
Условия реакции: H2O, HgSO4, конц. H2SO4
При гидратации алкинов реакция идет через образование нестабильного енола, который преобразуется в этаналь (альдегид) при использовании этина и в различные кетоны при использовании всех других алкинов. В случае несимметричных алкинов необходимо учитывать поляризацию алкина за счет донорного влияния алкильной группы, как, например, в пропине.


