
- •Строение алканов
- •Реакционная способность алканов. Реакции замещения атомов водорода в алканах.
- •Реакция Дюма
- •2.Синтез из иодистых алкилов
- •Строение алкенов
- •3. Виды изомерии
- •Реакционная способность алкенов
- •II. Реакции окисления
- •1. Окисление (гидроксилирование-введение двух гидроксильных групп) в в нейтральной среде без нагревания (реакция Вагнера).
- •2.Окисление в жестких условиях
- •2. Препаративные (лабораторные) способы получения
- •II. Реакции замещения с участием терминального атома водорода.
- •III. Реакции окисления.
- •Методы получения алкинов
- •1.Синтез ацетилена
- •Сопряженные диены
- •Строение сопряженных диенов
- •4. Гидрогалоидирование, (АdE)
- •Циклоалканы
- •Циклопропан
- •Электронное строение циклопропана
- •Циклобутан
- •Циклопентан
АЛКАНЫ
Номенклатура, суффикс ан


Изомеры – это соединения, имеющие одинаковый состав, но различное строение. Для алканов характерна структурная изомерия (различное соединение атомов углерода) или изомерия цепи. В других классах соединений мы будем описывать еще несколько вариантов изомерии.
Строение углеводородных радикалов (остатков) и их названия, использующиеся в названиях всех разветвленных алканов, алкенов, алкинов, аренов, а также в названиях галогенопроизводных, спиртов и аминов. В алканах различают первичные, вторичные, третичные и четвертичные атомы углерода.
Первичные атомы углерода (п) имеют в качестве “соседа” только один атом углерода.
Вторичные атомы углерода (в) имеют в качестве “соседей” два атома углерода.
Третичные атомы углерода (т) имеют в качестве “соседей” три атома углерода.
Четвертичные атомы углерода (ч) имеют в качестве “соседей” четыре атома углерода.

Углеводородные радикалы (остатки) образуются, если умозрительно отнять один атом водорода от различных по типу атомов углерода в алкане, поэтому мы имеем набор первичных, вторичных и третичных углеводородных остатков или углеводородных радикалов. Ниже приведено строение углеводородных радикалов, образованных от метана, этана, пропана, бутана и изобутана Тип углеводородного радикала соответствует типу атома улерода, имеющего вакантную связь.

Правила формирования названий алканов по номенклатуре IUPAC:
Найти самую длинную цепь – родоначальная цепь, остальные фрагменты молекулы называются заместителями.
Пронумеровать найденную цепь с того конца, к которому ближе заместитель.
Назвать соединение.
Примеры названий для алканов:

Строение алканов
1. Атом углерода находится в sp3-гибридизации, имеет пирамидальное строение.
2. а) Пространственное строение метана и бутана: (указаны углы связей и длины связей С-С и С-Н) представлено ниже.

Энергия С-С связи ЕС-С= 351 кДж/моль, длина С-С связи 0,154 нм
Реакции алканов протекают с разрывом С-Н и С-С связей по радикальному механизму (реакции, связанные с разрывом С-С связей в данном курсе не рассматриваются) в специальных условиях (нагревание, свет), в нормальных условиях реакции не идут.
Реакционная способность алканов. Реакции замещения атомов водорода в алканах.
Для алканов наиболее характерны реакции замещения атомов Н на другие атомы и группы атомов в специальных условиях, реакции не идут при 200С и в отсутствии УФ-излучения. Подвижность атомов водорода в алканах зависит от величины энергии связи С-Н. Наиболее реакционноспособными являются атомы водорода при третичных атомах углерода, т.к. энергия связи СТ -Н имеет наименьшую величину.
Реакционная способность связей С-Н:
СТ -Н СВ -Н СП –Н
Качественные реакции:
Отсутствие обесцвечивания растворов Br2 и KMnO4 в воде при 200С.
1.Галоидирование – замещение атомов водорода алканов на галоген.
Условия реакций: Cl2/h (свет); Br2/ t0 (1000C)
Преимущественно рассматриваются реакции хлорирования и бромирования. с Реакция с фтором идет бурно и с образованием продуктов разрыва не только всех С-Н, но и С-С-связей. Реакция с иодом практически не идет.
Примеры реакций
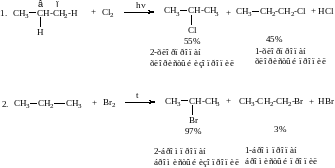
Первое название продуктов реакции соответствует названию по номенклатуре IUPAC, второе название систематическое дано по названию углеводородного остатка.
Реакции с Br2 протекает с высокой степенью селективности (т.е. количество одного из изомерных продуктов в смеси значительно преобладает), поэтому допускается написание в уравнении реакции только преимущественно образующегося соединения, т.е. бромистого изопропила. Далее приводится детальное описание хода реакции бромирования или ее механизм.
Механизм реакции галоидирования на примере бромирования пропана
Реакции замещения в алканах относятся к свободно-радикальным процессам. Свободный радикал – электрически нейтральная частица, имеющая неспаренный электрон, является промежуточным соединением в описываемых реакциях. Для обозначения механизмов реакций используются две латинские буквы. Первая определяет направление реакции, чаще всего – это замещение - S или присоединение – Ad. Вторая буква в виде подстрочного индекса уточняет через какое промежуточное соединение или интермедиат идет реакция: свободный радикал – R, электрофил – Е, нуклеофил – Nu. Для реакций свободно радикального замещения используется значок SR.
SR

 Третий
этап реакции – обрыв цепи, т.е. рекомбинация
образовавшихся свободных радикалов мы
не рассматриваем.
Третий
этап реакции – обрыв цепи, т.е. рекомбинация
образовавшихся свободных радикалов мы
не рассматриваем.
2. Нитрование – замещение атомов водорода алканов на нитрогруппу
(-NO2).
Условия реакции: разбавленная HNO3, t°, p (давление), нитрование в этих условиях называется нитованием по Коновалову.

В процессе нитрования образуются нитроалканы (R-NO2), которые называют только по номенклатуре IUPAC. При нитровании изобутана реакция идет преимущественно по третичному атому углерода, как и в случае бромирования (минорный продукт не указан).

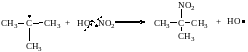
3. Сульфохлорирование – замещение атомов водорода в алканах на группу


хлорангидрид 2-пропансульфокислоты
При сульфохлорировании реакция идет с участием всех типов атомов С (в реакции указан один из продуктов), получают смеси хлорангидридов алкансульфокислот (алкансульфоновых кислот).
Алканы не реагируют с металлами, водой, галогеноводородными кислотами.
Методы получения
