- •Циклические углеводороды.
- •Способы получения циклоалканов.
- •Химические свойства циклоалканов.
- •Каталитическое гидрирование:
- •Присоединение галогенов:
- •Окисление циклоалканов.
- •Ароматические углеводороды.
- •Способы получения бензола.
- •Способы получения гомологов бензола.
- •Химические свойства бензола и его гомологов.
- •Реакции замещения.
- •Хлорирование.
- •Реакция сульфирования:
- •Реакции окисления.
- •Домашнее задание №4. Вариант 1, 16
- •Вариант 3, 18
- •Вариант 4, 19
- •Вариант 5, 20
- •Вариант 6, 21
- •Вариант 7, 22
- •Вариант 8, 23
- •Вариант 9, 24
- •Вариант 10, 25
- •Вариант 11, 26
- •Вариант 12, 27
- •Вариант 13, 28
- •Вариант 14, 29
- •Вариант 15, 30
Присоединение галогенов:
По-разному идет реакция взаимодействия галогенов с циклоалканами. Циклопропан легко реагирует с бромной водой (при комнатной температуре). Реакция сопровождается размыканием цикла и присоединением атомов брома к углеродам.
![]()
Циклобутан взаимодействует с бромом уже при более высокой температуре.
![]()
Пяти- и шестичленные циклы наиболее устойчивы, они не разрываются при действии галогена. В этом случае происходит свойственная предельным углеводородам реакция замещения.
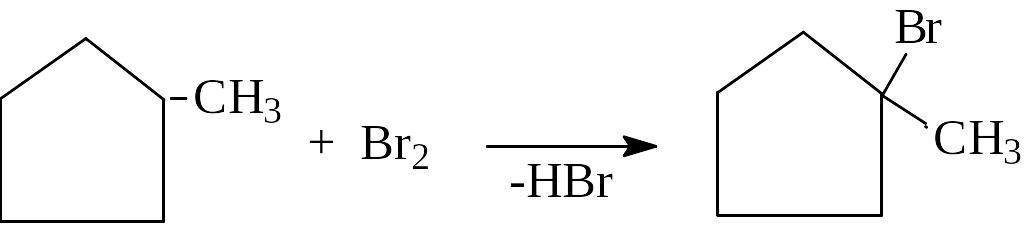
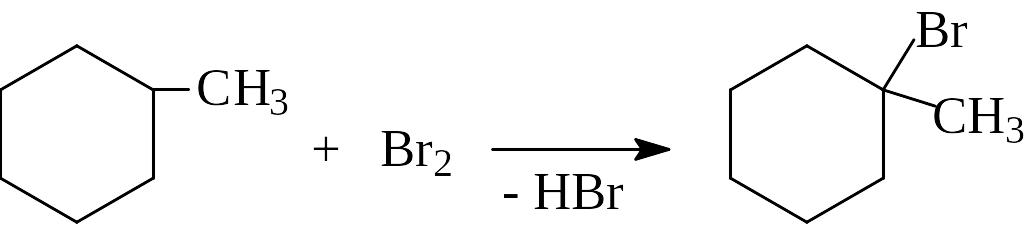
Действие галогеноводородов(+HHal ).
Циклопропан легко присоединяет бромоводород с размыканием цикла и образованием бромистого пропила.
![]()
Циклобутан взаимодействует с бромоводородом при более высокой температуре, но принцип реакции тот же – присоединение.
![]()
Циклопентан и циклогексан с бромоводородом не взаимодействуют.
Окисление циклоалканов.
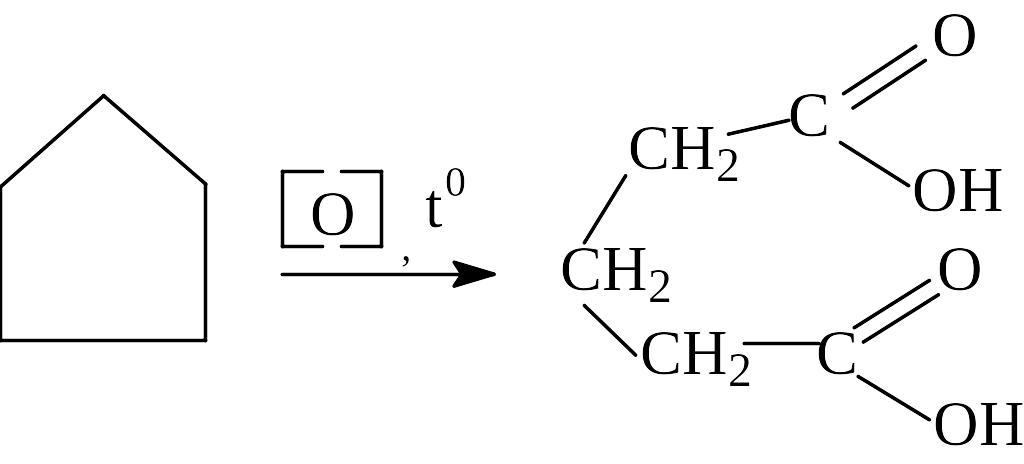
Реакция окисления циклопропана медленно происходит при комнатной температуре даже в мягких условиях (окислитель - КМnО4 в нейтральной или щелочной среде). Проведение реакции окисления в более жестких условиях (нагрев, КМnО4 в кислой среде) позволяет окислить и другие циклоалканы. При этом происходит разрыв цикла и образование двухосновных карбоновых кислот с тем же числом атомов углерода в молекуле.
Ароматические углеводороды.
К циклическим
углеводородам относятся и ароматические
углеводороды, из которых наиболее
простыми являются бензол (С6Н6)
и его гомологи (общая формула СпН2n-6
при п![]() 6).
Каждый
из шести атомов углерода в молекуле
бензола находится в состоянии
sp2-гибридизации
и связан с двумя соседними атомами
углерода и атомом водорода тремя
σ-связями. Валентные углы равны 120.
Таким образом, скелет
σ-связей
представляет собой правильный
шестиугольник, в котором все атомы
углерода и водорода лежат в одной
плоскости. Ниже приведена модель
образования σ-связи
С–С
и С–Н
6).
Каждый
из шести атомов углерода в молекуле
бензола находится в состоянии
sp2-гибридизации
и связан с двумя соседними атомами
углерода и атомом водорода тремя
σ-связями. Валентные углы равны 120.
Таким образом, скелет
σ-связей
представляет собой правильный
шестиугольник, в котором все атомы
углерода и водорода лежат в одной
плоскости. Ниже приведена модель
образования σ-связи
С–С
и С–Н

р-Электроны всех атомов углерода взаимодействуют между собой путем бокового перекрывания соседних р-орбиталей, расположенных перпендикулярно плоскости σ-скелета бензольного кольца. Они образуют единое циклическое π-электронное облако, сосредоточенное над и под плоскостью кольца.
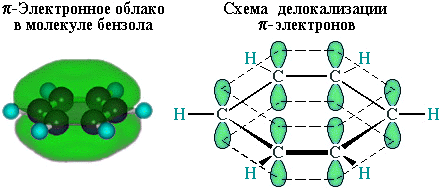
Все связи С–С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф.Кекуле), а все они выровнены (делокализованы). Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (σ-скелет) и кружка внутри него, обозначающего делокализованные π-связи:
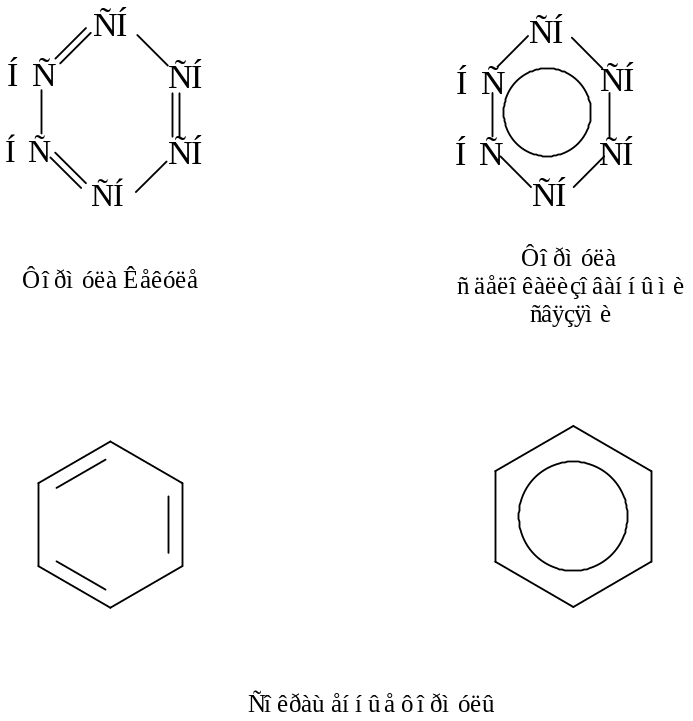
Формула Кекуле также нередко используется, но при этом учитывается, что она лишь условно передает строение молекулы.
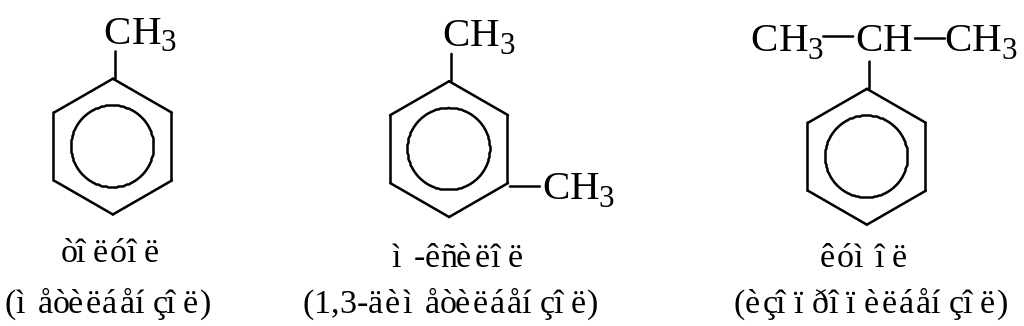
Приведем наиболее часто встречающиеся гомологи бензола, имеющие тривиальные названия: