- •Циклические углеводороды.
- •Способы получения циклоалканов.
- •Химические свойства циклоалканов.
- •Каталитическое гидрирование:
- •Присоединение галогенов:
- •Окисление циклоалканов.
- •Ароматические углеводороды.
- •Способы получения бензола.
- •Способы получения гомологов бензола.
- •Химические свойства бензола и его гомологов.
- •Реакции замещения.
- •Хлорирование.
- •Реакция сульфирования:
- •Реакции окисления.
- •Домашнее задание №4. Вариант 1, 16
- •Вариант 3, 18
- •Вариант 4, 19
- •Вариант 5, 20
- •Вариант 6, 21
- •Вариант 7, 22
- •Вариант 8, 23
- •Вариант 9, 24
- •Вариант 10, 25
- •Вариант 11, 26
- •Вариант 12, 27
- •Вариант 13, 28
- •Вариант 14, 29
- •Вариант 15, 30
Циклические углеводороды.
Циклическими называют соединения, имеющие замкнутые углеродные цепи. Такими циклическими углеводородами являются циклоалканы, имеющие общую формулу Сn H2n . Молекулы незамещенных циклоалканов состоят из замкнутых в цепь
–СН2– групп и по рациональной номенклатуре их называют полиметиленовыми углеводородами. По номенклатуре ИЮПАК названия углеводородов образуются путем добавления приставки цикло- к названию соответствующего алкана.
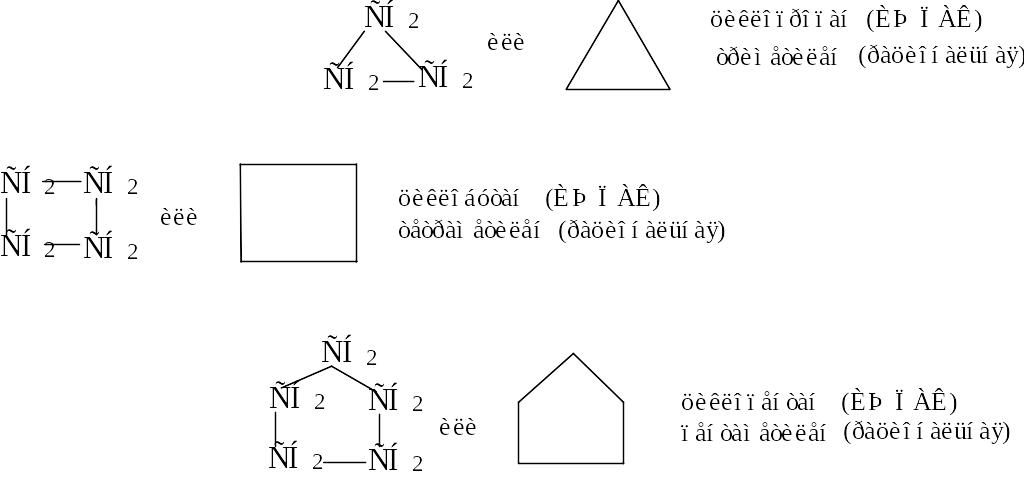
Часто для упрощения пользуются условными формулами, в которых опущены символы элементов.
Способы получения циклоалканов.
Циклоалканы можно получить путем дегалогенирования с помощью цинка или натрия дигалогенопроизводных углеводородов или каталитическим гидрированием бензола и его производных.
Дегалогенирование:
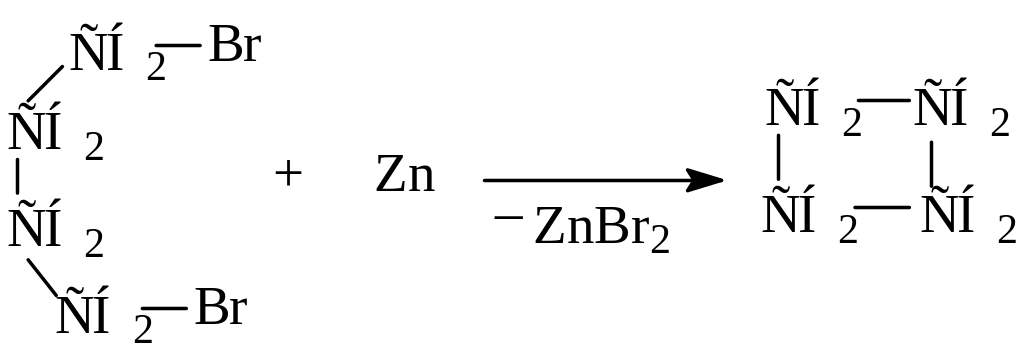
Каталитическое гидрирование ароматических углеводородов:
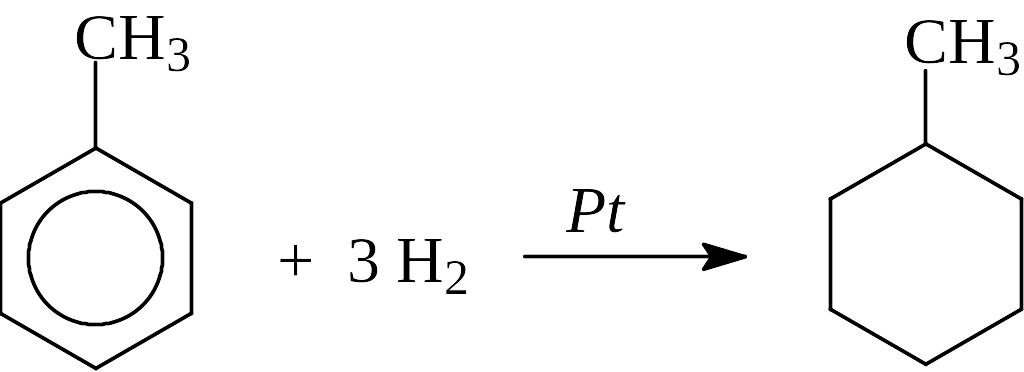
Химические свойства циклоалканов.
Реакционная способность циклоалканов зависит от размера цикла. Малые циклы
(трех- и четырехчленные циклы) наименее устойчивы, поэтому для таких циклических углеводородов характерны реакции, сопровождающиеся разрывом цикла, с последующим присоединением атомов реагента (атомов водорода или галогена). Для циклических парафиновых (циклоалканов )углеводородов с размером цикла (С5 – С7) свойственны реакции замещения.
Впервые связать устойчивость циклов с особенностями их строения сделал Байер. В основу созданной им теории «напряжений» он положил тетраэдрическую модель атома углерода (валентный угол 109°28'). Байер предположил, что любой цикл является плоским многоугольником. Рассматривая циклические соединения, он указал на отклонения валентных углов в циклах от идеального тетраэдрического и связал с этим отклонением относительную устойчивость циклоалканов (чем больше отклонение, тем сильнее «напряжение» в молекуле и тем меньше устойчивость цикла). Значение отклонения вычисляют как половину разности между 109°28' и величиной внутреннего угла правильного многоугольника. Например, для трехчленного цикла этот угол равен: (109°28' – 60)/2 = +24°44' (рис.1).
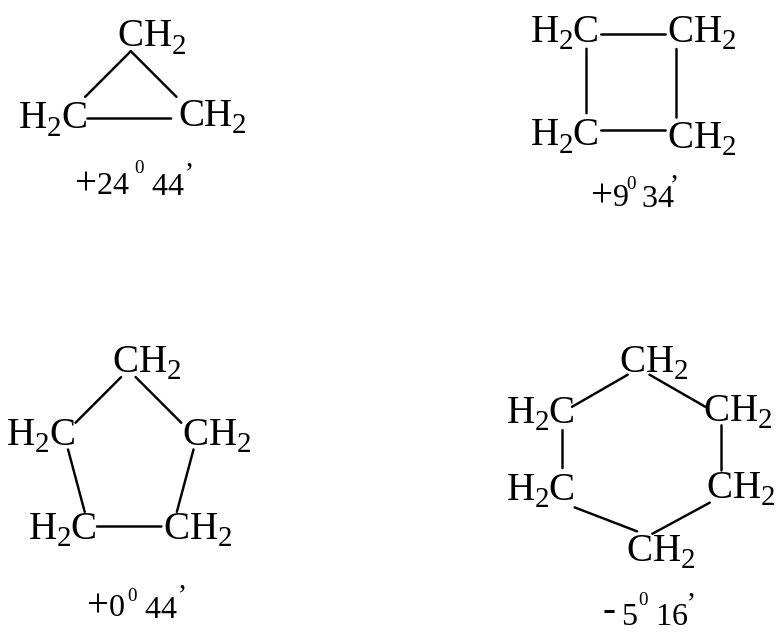
Рис. 1. Отклонения валентных углов от тетраэдрического в циклических соединениях с разным числом атомов углерода в цикле (по Байеру).
Теория Байера работает только для циклов С3 – С5, наиболее устойчивыми (свободными от «напряжения») являются пятичленные циклы (наименьшее отклонение от тетраэдрического угла), в то время как максимальной стабильностью (и наибольшей распространенностью в природе), как известно, обладают шестичленные циклы — гексан и его производные.
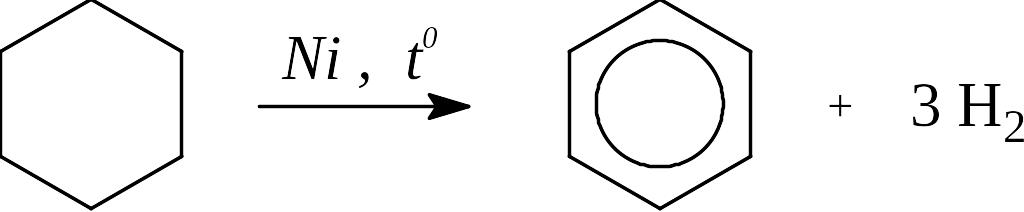
Каталитическое гидрирование:
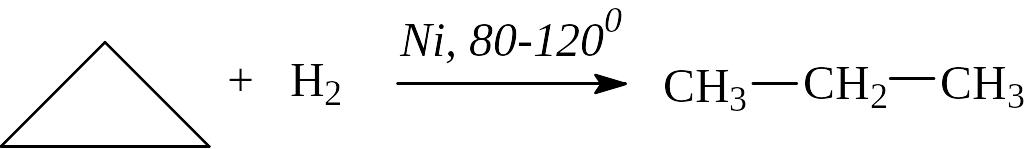
![]()
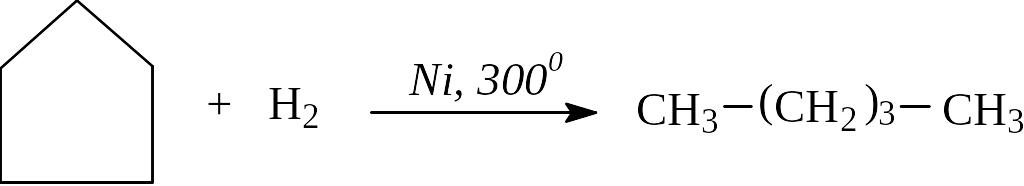
Отметим, что снижение «напряжения» в цикле по теории Байера в ряду С3 – С5 приводит к возрастанию устойчивости молекул и, как следствие, к повышению температуры реакции гидрирования циклоалканов.
Циклогексан в этих же условиях не размыкается, а протекает реакция дегидрирования с образованием бензола.