
- •Внутренняя среда организма. Кровь. Физиология дыхания.
- •Часть III
- •Гематокрит
- •Структура и функции плазмы крови
- •Водные пространства организма Три основных водных пространства
- •Неэликтролиты: глюкоза, мочевина Осмотическое давление плазмы
- •Белки плазмы
- •Альбумины альбумины 59,2 %
- •Значение белков плазмы
- •Тема № 3: «Внешнее дыхание»
- •Тема №4: «Газы крови и их транспорт. Регуляция дыхания»
Гематокрит
Гематокритом называется часть объема крови, приходящаяся на долю эритроцитов.
У мужчин гематокрит – 0,44 – 0,46
У женщин гематокрит – 0,41 – 0,43
Гематокрит определяется по методу Унитроба, с помощью центрифугирования (центрифуга Шкляра) путем разделения в стандартной пробирке (или капилляре) на плазму и эритроциты.
Значение гематокрита крови, взятой из разных органов различаются благодаря особым реологическим свойствам эритроцитов.
Гематокрит связан с вязкостью крови.
Вязкость Н2О = 1,0
Вязкость крови = 4,5 (3,5-5,4)
Вязкость плазмы = (1,9-2,6)
Увеличение гематокрита сопровождается увеличением вязкости крови и как следствие повышению нагрузки на сердце.
Структура и функции плазмы крови
В 1 л плазмы человека содержится 900-910 г Н2О, 65-80 г белка и 20 г низкомолекулярных соединений.
Удельный вес плазмы = 1,025 – 1,029
рН = 7,37 – 7,43 (средн. 7,4)
Водные пространства организма Три основных водных пространства


 Желудок
кишечник
Желудок
кишечник





 плазма
крови 3 л обмен более 70 % всей
межклеточная интерстициальная
жидкости
плазма
крови 3 л обмен более 70 % всей
межклеточная интерстициальная
жидкости

 жидкость 10 л плазмы происходит
внутриклеточная жидкость 30 л
за 1 мин.
жидкость 10 л плазмы происходит
внутриклеточная жидкость 30 л
за 1 мин.
Состав плазмы и интерстициальной жидкости различается лишь по концентрации белков (крупные белки не могут свободно проходить через стенки капилляров).
Электролиты плазмы
Катионы: Na, K, Ca, Mg
Анионы: Cl, HCO3, HRO4, хлор, бикарбонат, фосфат, сульфат,
органические кислоты, белки.
Неэликтролиты: глюкоза, мочевина Осмотическое давление плазмы
Концентрация растворенных в плазме веществ может быть выражено как осмотическое давление – в норме 7,3 атм (5600 мм рт. ст.).
Любое отклонение осмотического давления плазмы крови и интерстицеальной жидкости от нормальных величин приводит к перераспределению воды между клетками и окружающей их средой.
Гипотоническая межклеточная жидкость приводит к выделению Н2О в клетку (она набухает).
Гипертоническая среда приводит к потере Н2О самой клетки – она сжимается.
В норме концентрация NaCl в межклеточном пространстве и клетках должны быть изотоничными (равными) 0,9 %.
Белки плазмы
С помощью электрофореза можно разделить белки.
Электрофорез белков плазмы является важным методом клинической диагностики. Многие заболевания сопровождаются характерными применениями в составе этих белков.
Электрофорезом называется – движение электрически заряженных частиц, находящихся во взвешенном состоянии или растворенных в жидкой среде, по градиенту напряжения.
Электрофорез
+








 -
-
бум. лента







Альбумины альбумины 59,2 %
a1- глобулины 3,9 %
a2 – глобулины 7,5 %
глобулины b-глобулины 12,1 %
g - глобулины 17,3 %
a1 a2 b g

Значение белков плазмы
Питание (на 3 литра плазмы приходится 200 г белка) это достаточный запас питательных веществ
Транспорт – благодаря наличию гидрофильных и гидрофобных участков, белки способны связываться с молекулами и жироподобными веществами и осуществлять их перенос по руслу крови. Кроме белка плазмы (БП) связывают 2/3 кальция плазмы переводя его в недиффуидируемую форму.
Создание коллоидно-осмотического давления (онкотическое) между плазмой и межклеточной жидкостью создается градиент концентрации белков.
Онкотическое давление плазмы – 25 мм рт. ст. (3,3 кПа)
Онкотическое давление межклеточной жидкости – 5 мм рт.ст. (0,7 кПа) (Разница 20 мм рт.ст.).
На сдвиги онкотического давления существенно влияет содержание альбумина.
Снижение концентрации альбумина приводит к задержке Н2О в межклеточном пространстве (интерстициальный отек).
Искусственные кровезаменители должны обладать таким же онкотическим давлением как и плазма крови.
Буферная функция – поддерживает постоянство рН крови путем связывания Н+ или ОН-.
Предупреждение кровопотери обусловлено наличием в плазме крови фибриногена. Цепь реакций (факторов), в которых участвуют белки плазмы заканчивается превращением растворенного в плазме фибриногена в сеть из молекул Фибрина, образующую сгусток (тромб).
Свойства и функции отдельных белковых факций
Альбумин плазмы – этот белок определяет на 80 % коллоидно-осмотическое (онкотическое) давление плазмы. 60 % общего белка плазмы приходится на долю альбумина (35-45 г/л).
Альбумин пикомолекулярное соединение и поэтому хорошо подходит для выполнения функции переносчиков многих транспортируемых кровью веществ.
Альбумин связывает: биллирубин, уробилин, жирные кислоты, соли желчных кислот, пенициллин, сульфамедин, ртуть.
При воспалительных процессах и поражении печени и почек количество альбумина снижается.
Глобулины
a1 – глобулины, иначе их называют – гликопротеинами 2/3 всего количества глюкозы плазмы присутствует в связанной форме в составе гликопротеинов. К субфикции гликопротеинов относится группа углеводосодержащих белков – протеогликаны (мукопротеины).
a2 – глобулины – это протеогликан или иначе медьсодержащий белок церулоплазмин, который связывает 90 % всей меди, содержащейся в плазме.
b-глобулин – это белковые переносчики липидов и полисахаридов. Важное значение ликопротеинов состоит в том, что они удерживают в растворе нерастворимые в воде жиры и липоиды и обеспечивают тем самым их перенос кровью.
g - глобулины. Это неоднородная группа белков выполняющих защитные и обезвреживающие функции, иначе называемые иммуноглобулинами. Размеры и состав g - глобулинов существенно варьирует. При всех заболеваниях, особенно воспалительных, содержание g - глобулинов в плазме повышается. К g - глобулинам относятся агглютинины крови: Анти-А и Анти-В.
Фибриноген – растворимый предшественник фибрина, последний превращается в нерастворимую форму. Молекула фибрина имеет удлиненную форму (соотношение длины ширина – 17:1)). Высокая вязкость растворов фибриногена обусловлена свойством его молекул образовывать сгустки в виде «ниток бус».
Эритроциты
Осмотическая стойкость эритроцитов:
минимальная 0,48—0,46 %
максимальная 0,34—0,32 %
Средний объем эритроцита 76—96 мк3
Среднее содержание гемоглобина в 1 эритроците 27—33,3 пг 0,42—0,52 ммоль/эритр
Средняя концентрация гемоглобина в 1 эритроците 30—38 % 4,65—5,89 ммоль/эритр
Диаметр эритроцита 5—6,9 мкм — 12,5 %
7—8 мкм — 75 %
8,1—9 мкм— 12,5%
ФАГОЦИТОЗ – поглощение чужеродных частиц или клеток и дальнейшее их уничтожение клетками крови.
Стадии фагоцитоза:
приближение фагоцита к объекту (лиганду);
контакт лигонда с мембраной фагоцита;
поглощение лигонда;
переваривание или уничтожение фагоцитарного объекта.
Действие лейкоцитов проявляется в присутствии особых соединений – хемоаттрактантов (продукты распада тканей, иммуноглобулины, фрагменты активных компонентов комплемента, простагландины, лейкотриены, лимфокины и монокины). Контакт фагоцита опосредуется особыми соединениями – опсонинами, усиливающими фагоцитоз. Наиболее известные опсонины: иммунные комплексы, фрагменты системы комплемента, С-реактивный белок, агрегированные белки, фибронектины и др.
В процессе фагоцитоза лиганд оказывается заключенным в мембрану фагоцита – образуется фагосома. Затем происходит ее слияние с лизосомами клетки и образуется фаголизосома.
Завершенный фагоцитоз – процесс, когда фагоцитируемый объект погибает, разрушается.
Незавершенный фагоцитоз - фагоцитируемый объект может жить и развиваться в фагоците.
Иммунитет – комплекс реакций, направленных на поддержание гомеостаза при встрече с чужеродными агентами экзогенного или эндогенного происхождения.
Антигены способны формировать специфический иммунный ответ благодаря наличию детерминант. К ним, как ключ к замку, подходят активные центры образующих антител или рецепторы клеточных мембран лейкоцитов, что формирует гуморальный и клеточный иммунитет.
Клеточный специфический иммунитет обусловлен Т-лимфоцитами. Гуморальный специфический иммунитет обеспечивается образованием В-лимфоцитами антител к данному антигену.
Иммунный ответ осуществляется иммуннокомплексными клетками:
антигенпрезентирующими: моноциты, макрофаги, эндотелиальные клетки, пигментные клетки кожи и др.
регуляторными: Т- и В-хелперы, супрессоры, Т-лимфоциты памяти.
эффекторы иммунного ответа: Т- и В-киллеры и В-лимфоциты антителопродуценты.
НЕОБХОДИМО УМЕТЬ:
1. Научиться технике взятия крови из пальца человека для лабораторного анализа.
2. Ознакомится с принципом и методикой подсчета эритроцитов. Подсчитать их количество в крови.
3. Ознакомится с принципом и методикой подсчета лейкоцитов. Подсчитать их количество в крови у одного из студентов.
4. Ознакомиться с колориметрической методикой определения количества гемоглобина по методу Сали и определить его количество в крови
5. Ознакомиться со свойствами осмотической устойчивости эритроцитов и произвести количественную оценку их резистентности по отношению к гипотоническим растворам.
РАБОТА№1
Техника взятия крови
Цель работы: научить студентов технике взятия крови из пальца человека для лабораторного анализа.
Необходимо для работы: испытуемый, стерильные копья-скарификаторы однократного пользования и пинцет, спирт, йод, вата, капилляр Сали и маленькая груша, стаканчик стеклянный (или чашка Петри) для собирания использованной ваты и копий, отдельный набор для промывания и просушивания капилляра, вода, эфир, резиновая трубка с маленькой грушей, большая груша для воздуха.
П р о в е д е н и е р а б о т ы:
Прежде чем приступить к забору крови, следует четко представить для каких целей нужна кровь, какой анализ будет проводиться, все ли подготовлено для проведения анализа!
Посадить испытуемого, продезинфицировать спиртом мякоть концевой фаланги безымянного пальца левой руки и подождать, пока поверхность кожи просохнет. Приступить к забору крови только после собеседования с преподавателем и под его контролем!
Положить предплечье левой руки пациента на стол, ладонью вверх. Достать стерильным пинцетом из стерилизатора продезинфицированное копье-скарификатор, взять его в правую руку, а левой неподвижно держать палец исследуемого, слегка сжимая с боковых поверхностей подготовленную фалангу.
Укол нанести одним отрывочным движением на 3-4 мм дистальнее центра подушечки пальца. Необходимо, чтобы кончик копья не просто поцарапал кожу, а вошел в мякоть фаланги до ограничения.
Первую выступившую каплю крови стереть сухой ватой (для анализа не использовать), затем приступить к забору крови для работы.
Выделение крови можно усилить легким массажем (но не сдавливанием) боковых поверхностей пальца в сторону концевой фаланги, а также периодически сжимая и разжимая опущенную вниз кисть. Если для анализа требуется не одна капля крови, а больше, то после взятия каждой следующей капли необходимо насухо вытирать палец и только после этого брать новую каплю. Нужно следить за тем, чтобы кровь не растекалась по пальцу (чтобы на пальце не начался процесс свертывания крови).
Набрать 20 мм3 (0,02 мл) крови в капилляр от гемометра Сали.
Для этого необходимо:
взять в правую руку чистый и сухой капилляр Сали с надетой на конец резиновой трубкой и маленькой грушей. Капилляр удерживать указательным, средним и большим пальцами в чуть наклонном положении. Грушу поместить в ладонь и мизинцем или безымянным пальцем слегка на нее нажать;
погрузив кончик капилляра в каплю крови (но, не прижимая отверстие к пальцу), начать медленно и очень аккуратно уменьшать нажатие на грушу. При этом столбик крови заполнит капилляр. Набрать кровь до метки 20 мм3;
капилляр снаружи вытереть сухой ватой. Если крови набралось немного больше, ее можно снять сухой ватой, которую прикладываю к кончику горизонтально расположенного капилляра (на грушу не нажимать!) Отмеренное количество крови взять для соответствующего анализа.
Стереть ватой остатки крови с пальца, смазать место укола йодом или приложить ватку, смоченную спиртом, и прижать кончик пальца к ладони.
Использованные вату и скарификаторы не разбрасывать по столу, а сложить в специальный стакан или чашку Петри и в конце работы выбросить. Убрать рабочий стол.
Использованный капилляр Сали промыть водой, просушить спиртом, эфиром и воздушной струей.
В протоколе кратко описать основные требования и правила, которые нужно соблюдать при взятии крови из пальца.
РАБОТА №2
Подсчет количества эритроцитов
Цель работы: ознакомится с принципом и методикой подсчета эритроцитов. Подсчитать их количество в крови одного из студентов.
Необходимо для работы: испытуемый, микроскоп с окуляром х 15, счетная камера Горяева, шлифованное покровное стекло, штатив с чистой и сухой пробирками (или специальные смесители для подсчета эритроцитов), бюретка или мерный цилиндр на 5-10 мл, капилляр Сали с резинкой и маленькой грушей, стеклянная палочка, стерильные скарификаторы и пинцет, спирт, йод, вата, 3% р-р хлористого натрия.
П р о в е д е н и е р а б о т ы:
Ознакомиться с устройством смесителя (меланжера) (рис.1). В настоящее время кровь для подсчета форменных элементов крови разводят не в смесителях, а в пробирках (пробирочный метод разведения по Николаеву).
Кровь для подсчета эритроцитов набрать в смеситель до метки 0,5 (или 1) и сюда же добавить раствор хлористого натрия до отметки 101. Кровь разводится в 200 раз. (Техника забора крови описана в работе №1).
При пробирочном разведении крови в чистую и сухую пробирку точно отмерить 4 мл хлористого натрия (512 мм/л). С помощью капилляра Сали набрать 20 мм3 крови и осторожно опустить ее на дно пробирки. Промыть этим же раствором (из верхнего слоя) капилляр и слегка встряхивая пробирку, тщательно перемешать содержимое.
Рассмотреть под микроскопом сетку счетной камеры Горяева (см. рис. 1).
Осторожно притереть покровное стекло к узким боковым пластинам камеры Горяева до появления колец Ньютона.
Заполнить камеру. Для этого из смесителя две-три капли крови следует выпустить на ватку, а затем заполнить камеру: кончик смесителя поднести к краю притертого покровного стекла – в силу закона капиллярности камера заполнится. Заполнение из пробирки: пробирку с разведенной кровью несколько раз встряхнуть, держа вертикально для равномерного перемешивания, сразу же после этого концом стеклянной палочки или капилляра Сали (не пользуясь грушей) перенести каплю смеси на сетку счетной камеры Горяева. Для этого кончик палочки или капилляра следует поднести к краю притертого покровного стекла. Необходимо следить за тем, чтобы под покровным стеклом не образовались пузырьки воздуха.
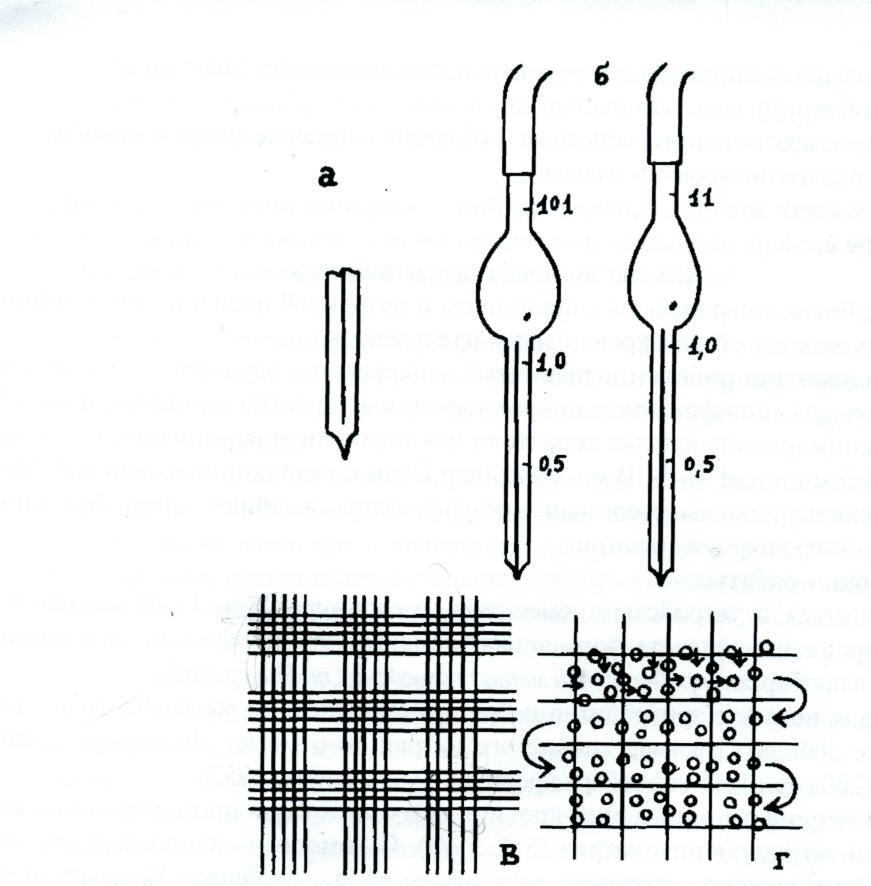
Рис. 1. Подсчет элементов крови: а - скарификатор; б - меланжеры; в - фрагмент сетки счетной камеры Горяева; г - схема подсчета эритроцитов (правило Егорова)
Через две-три минуты поместить камеру под микроскоп и сосчитать эритроциты (при окуляре микроскопа х 15 можно считать под малым увеличением).
Техника подсчета. Эритроциты подсчитывают в пяти больших квадратах расположенных по диагонали сетки счетной камеры Горяева, каждый из которых разделен на 16 маленьких квадратиков (всего их 80). Форменные элементы в квадратиках подсчитывают по правилу Егорова (см.рис. 1,г):
из эритроцитов, лежащих на границах, относить к данному квадратику только те, которые лежат на верхней и левой границах;
порядок просмотра маленьких квадратиков в большом – по зигзагу.
Записать результаты подсчета в каждом квадратике и просуммировать число эритроцитов.
9. Рассчитать количество эритроцитов в 1 мкл крови при ее разбавлении в 200 раз по следующей формуле: Сэх200 х 4000, где Сэ – сумма
подсчитанных эритроцитов 80
В протоколе кратко описать ход работы, внести полученные данные и сделать выводы (соответствие физиологической норме).
РАБОТА №3
Подсчет количества лейкоцитов
Цель работы: познакомится с принципом и методикой подсчета лейкоцитов. Подсчитать их количество в крови у одного из студентов.
Необходимо для работы: испытуемый, микроскоп с окуляром 10 или15, счетная камера Горяева, шлифованное покровное стекло, штатив с маленькой пробиркой, бюретка или мерный цилиндр на 3-5 мл с делениями в долях мм, капилляр Сали с резиновой трубкой и маленькой грушей, смеситель для лейкоцитов, стеклянная палочка, стерильные скарификатор и пинцет, спирт, йод, вата, 5%-ный р-р уксусной кислоты, окрашенный метиленовым синим.
П р о в е д е н и е р а б о т ы:
Кровь из пальца набрать в смеситель до метки 0,5 и сюда же добавить р-р уксусной кислоты до метки 11. Зажав двумя пальцами отверстия, меланжер тщательно встряхнуть.
При пробирочном разведении в чистую и сухую пробирку точно отмерить 0,4 мл р-ра уксусной кислоты. Набрать с помощью капилляра Сали 20 мм3 крови и осторожно выпустить ее на дно пробирки. Промыть этим же раствором из верхнего слоя капилляр и, осторожно встряхнуть пробирку, тщательно перемешать содержимое. Полученное разведение 1:21 можно принять за 1:20.
Далее, провести опыты как описано в пп.5-8 работы №2
Техника подсчета. Сосчитать количество лейкоцитов в 25 больших квадратах под малым увеличением, пользуясь правилом Егорова.
Рассчитать количество лейкоцитов при разбавлении крови в 20 раз по формуле:
Л=Слх20 х 4000, где Сл – сумма подсчитанных лейкоцитов.
400
В протоколе кратко описать ход работы, внести полученные данные и сделать выводы (соответствие физиологической норме).
РАБОТА №4
Определение количества гемоглобина
Цель работы: ознакомиться с колориметрической методикой определения количества гемоглобина по методу Сали и определить его количество в крови у одного из студентов..
Необходимо для работы: испытуемый, гемометр Сали, стерильные скарификатор и пинцет, спирт, йод, вата, 0,1 N р-р соляной кислоты, дистиллированная вода.
П р о в е д е н и е р а б о т ы:
Набрать в градуированную пробирку гемометра Сали 0,2 мл (до нижнего кругового кольца) децинормального раствора соляной кислоты. Кислоту набирать обычной пипеткой, имеющейся в приборе (рис.2)
Проколоть палец и набрать капилляром Сали 20 мм3 крови.
Кровь желательно взять у того же студента, у которого определяли количество эритроцитов.
Погрузив кончик капилляра в раствор HCl, выпустить кровь на дно градуированной пробирки под кислоту, а из верхнего слоя раствора промыть два-три раза капилляр (следить за тем, чтобы не образовалась пена).
Встряхивая пробирку легкими ударами пальца по ее дну, быстро перемешать содержимое, чтобы предотвратить образование сгустка на дне.
Вставить градуированную пробирку в корпус гемометра, оставить на пять минут до полного гемолиза и образования соляного гематина (темно-коричневый цвет).
Пипеткой добавлять по каплям дистиллированную воду до выравнивания цвета полученной смеси с цветом стандартных растворов. Каждый раз после добавления воды содержимое пробирки тщательно перемешивать стеклянной палочкой. Сравнивать цвета следует в проходящем дневном свете, держа гемометр в вытянутой руке.
Определить количество гемоглобина в исследуемой крови в г% по показаниям шкалы градуированной пробирки на уровне нижнего мениска окрашенного раствора.
Рассчитать количество гемоглобина в относительных единицах Сали. Пересчет произвести с учетом того, что в стандартном растворе 166,7 г/л (16,67%) гемоглобина соответствуют отн. ед. Сали.
В протоколах кратко описать ход работы, внести полученные результаты и сделать выводы о соответствии физиологической норме.

Рис. 2. Схема гемометра Сали: 1 - пробирки со стандартным раствором хлорида гематина; 2 – пробирка для определения количества гемоглобина; 3 – пипетка для крови; 4 - пипетка для воды; 5 – палочка для размешивания.
РАБОТА №5
Определение осмотической резистентности эритроцитов
Цель работы: ознакомиться со свойствами осмотической устойчивости эритроцитов и произвести количественную оценку их резистентности по отношению к гипотоническим растворам.
Необходимо для работы: восемь чистых и сухих пробирок, штатив, мерный цилиндр на 5-10 мл, 1%-ный раствор хлористого натрия, дистиллированная вода, стерильные скарификаторы и пинцет, спирт, йод, вата, стеклянные палочки, мерные пипетки.
П р о в е д е н и е р а б о т ы:
В каждую из пробирок налить 1%-ный раствор хлористого натрия в убывающем количестве от 0,6 до 0,15 мл, затем в каждую пробирку добавить дистиллированной воды до 1 мл. Пробирки пронумеровать.
Во все пробирки добавить с помощью капилляра Сали по капле крови. Добавление крови лучше начинать с пробирки, в которую помещен раствор с наименьшей концентрацией, и идти в сторону увеличения. Осторожно перемешать содержимое, чтобы не образовались пузырьки воздуха.
Оставить пробирки в штативе на хорошо освещенном месте на 30-40 мин, после чего рассмотреть их содержимое (не взбалтывать!). Проанализировать результаты.
О границах (уровне) осмотической резистентности эритроцитов судить по степени гемолиза крови в различных гипотонических растворах.
Результаты наблюдений занести в таблицу:
Концентрация растворов (%) |
Результаты наблюдений |
выводы |
|||
Цвет верхнего прозрачного |
Вид остальной части раствора |
осадок |
степень гемолиза |
уровень резистентности |
|
0,60 |
|
|
|
|
|
0,55 |
|
|
|
|
|
0,50 |
|
|
|
|
|
0,45 |
|
|
|
|
|
0,40 |
|
|
|
|
|
0,35 |
|
|
|
|
|
0,30 |
|
|
|
|
|
0,25 |
|
|
|
|
|
И т.д. |
|
|
|
|
|
Отметить пробирки, в которых:
отсутствует гемолиз;
частичный гемолиз;
полный гемолиз.
В выводах дать определение верхней и нижней границ резистентности эритроцитов и сделать заключение о соответствии полученных результатов физиологической норме.
Тема №2: «Группы крови, правила переливания крови. Свертывание крови. Гемостаз его регуляция».
НЕОБХОДИМО ЗНАТЬ:
Группы крови, правила переливания крови.
Резус-фактор. Механизмы формирования резус-конфликтных ситуаций.
Система гемостаза. Сосудисто-тромбоцитарный гемостаз.
Внутрисосудистая коагуляция. Факторы свертывания крови. Основные стадии образования тромба фибринового происхождения.
Фибринолиз. Внешний и внутренний механизмы фибринолиза.
Противосвертывающая система организма, ее физические и химические компоненты.
Регуляция свертывания крови и фибринолиза. Взаимодействие свертывающей и противосвёртывающей систем.
Лимфа и тканевая жидкость, состав и механизм образования. Циркуляция лимфы в организме, значение лимфатических узлов, роль лимфооттока в обмене воды в организме.
Ключевые понятия и определения
Свертывающая система крови – это совокупность факторов, участвующих в процессах крови. Изучение процессов свертывания крови. Изучение процессов свертывания крови имеет практическое значение при переливании крови для сохранения ее в жидком состоянии, для предупреждения смертельных кровотечений, предотвращения образования тромбов в сосудах и лечения внутрисосудистых тромбозов.
Противосвертывающая система крови – это совокупность содержащихся в крови веществ, препятствующие образованию кровянистого сгустка и его ретракции.
Группы крови
В эритроцитах, на мембране находятся антитела (агглютиногены) А и В, а в плазме - антитела (агглютинины) α и β. В зависимости от присутствия различных антигенов и антител выделяют 4 группы крови. При сочетании одноименных антител с антигенами происходит агглютинация (склеивание) эритроцитов, что в дальнейшем приводит к развитию гемотрансфузионного шока.
Существует еще один антиген – Д (резус-фактор), который может присутствовать в эритроцитах независимо от групповой принадлежности. Антител к данному антигену не существует, однако они могут образовываться при иммунизации организма кровью, содержащей резус-фактор (Rh), и в дальнейшем при переливании резус-положительной крови иммунизированному реципиенту может произойти агглютинация эритроцитов донорской крови.
группа |
Антигены |
антитела |
I (0) |
- |
α, β |
II (A) |
A |
B |
III (B) |
B |
A |
IV (AB) |
A,B |
- |
НЕОБХОДИМО УМЕТЬ:
1.Ознакомиться с принципами и методикой определения СОЭ по Панченкову и определить ее у студентов.
2. Рассчитывать цветной показатель крови.
3. Определять время свертывания крови
4. Определять продолжительности кровотечения.
5. Определять группу крови резус- принадлежности крови человека.
РАБОТА №6
Определение скорости оседания эритроцитов
Цель работы: ознакомиться с принципами и методикой определения СОЭ по Панченкову и определить СОЭ у студентов.
Необходимо для работы: испытуемый, прибор Панченкова, два часовых стекла или тигелечка, 5%-ный раствор лимонно-кислого натрия (цитрат натрия), стерильные скарификаторы и пинцет, спирт, йод, вата.
П р о в е д е н и е р а б о т ы:
Рассмотреть капилляр Панченкова (рис. 3), разобрать все его цифры и метки (О - на уровне 100 мм; Р- на уровне 50 мм).
Налить немного цитрата на часовое стекло или тигелек, промыть им капилляр.
Удалить продуванием образовавшиеся в капилляре пузырьки, чтобы предотвратить возникновение воздушных пробок при последующем наборе в капилляр.
Отметить этим же капилляром 50 мм раствора цитрата натрия, набрав его до метки Р, и выпустить на чистое часовое стекло.
Проколоть палец и, сняв первую каплю, приступить к взятию крови.
Взять капилляр в правую руку так, чтобы видеть все деления. Погрузить его кончик в каплю крови, не прижимая отверстие плотно к пальцу, свободный конец капилляра опустить несколько ниже горизонтального уровня.
Быстро набрать 100 мм крови без пузырьков (до метки К). Растекающиеся капли стереть влажной ваткой, смоченной раствором цитрата.
Осторожно, не допуская пузырей, выдуть всю порцию крови в отмеренный раствор цитрата и тщательно перемешать концом капилляра.
Вновь промыть капилляр раствором цитрата, еще раз набрать в него кровь до метки К и осторожно выдуть на то же стекло.
Все хорошо перемешать и затем набрать часть получившейся смеси (без пузырьков воздуха) в капилляр до метки К. Разведение 1:4.
Кровь набирать самотеком, для чего капилляр наклонить несколько ниже горизонтального уровня по отношению к часовому стеклу с разведенной кровью
Зажать указательным пальцем правой руки верхний конец капилляра, повернуть его вертикально и вставить в штатив. Палец можно отпустить только после того, как вы твердо убедились в том, что нижний конец капилляра прижат к резинке на стойке прибора Панченкова.
Засечь время установки капилляра в штатив. Штатив с места не сдвигать.
Судить о величине СОЭ по высоте столбика плазмы (мм), освободившейся от эритроцитов за один час стояния крови (прозрачный слой).
В протоколе кратко описать ход работы, зарисовать капилляр с нанесенными метками. Записать время СОЭ. Сравнить полученные результаты с физиологической нормой.

Рис.3. Система прибора Панченкова. А – общий вид прибора; Б – капилляр с метками К (кровь) и Р (реактив).
РАБОТА №7
Вычисление цветного показателя крови
Цель работы: научиться рассчитывать цветной показатель крови.
Необходимо для работы: данные определения содержания гемоглобина в крови и количество в ней эритроцитов (взять из предыдущих работ).
П р о в е д е н и е р а б о т ы:
Для вычисления цветного показателя крови количество гемоглобина, выраженное в относительных процентах (по отношению к стандарту, принимаемому за 100%), делят на три первые цифры числа эритроцитов, и полученное значение умножают на 5. Такой способ вычисления рассчитан на то, что в идеальных условиях (при содержании гемоглобина 100% и эритроцитов 5 млн. в 1 мм3 крови) – цветной показатель соответственно равен (100:500)х5=1.
Если цветной показатель меньше единицы, то такое явление называется – гипохромазией, больше единицы – гиперхромазией.
Рассчитать цветной показатель и дать ему оценку, сравнить с физиологической нормой.
РАБОТА №8
Определение скорости свертывания крови
Цель работы: научиться определять время свертывания крови по одной из предлагаемых методик.
Методика по Сухареву
Необходимо для работы: испытуемый, чистый и сухой капилляр от прибора Панченкова, стерильный скарификатор и пинцет, спирт, йод, вата.
П р о в е д е н и е р а б о т ы:
Проколоть палец, снять первую каплю крови сухой ваткой.
Погрузить конец капилляра в каплю крови, не прижимая отверстия к пальцу.
Слегка опустив наружный конец капилляра, набрать 20-30 мм крови и перевести этот столбик крови на середину.
Держа капилляр двумя пальцами, произвести плавное покачивание его в обе стороны с амплитудой 40-450.
Свободное смещение столбика крови говорит о том, что свертывание еще не наступило. Замедленное движение крови при наклоне капилляра характеризует начало свертывания, при этом на внутренней стенке капилляра появляются небольшие сгустки.
Момент полной остановки движения столбика крови в капилляре соответствует наступлению окончательного свертывания крови. По предлагаемой методике скорость свертывания крови в норме: начало свертывания происходи через 30 с – 2 мин., полное свертывание – через 3-5 мин.
Методика, модифицированная Агаджаняном
Необходимо для работы: испытуемый, парафинированное часовое стекло (можно предметное стекло, покрытое парафином), стеклянный крючок, стерильный скарификатор и пинцет, спирт, йод, вата.
П р о в е д е н и е р а б о т ы:
Проколоть палец так, чтобы на поверхность кожи выступила капля крови.
Стеклянной палочкой перенести каплю на парафинированное стекло.
Через каждые 30 с, погружая стеклянный крючок в каплю крови, следить за образованием нитей фибрина.
Интервал времени между нанесением капли крови на стекло и появлением фибриновых нитей принимать за время свертывания.
Необходимо учесть, что по данной методике время свертывания в норме составляет около 3-5 мин.
В протоколе описать, по какой методике и как определялось время свертывания. Результаты записать и сравнить с физиологической нормой.
РАБОТА №9
Определение продолжительности кровотечения
Метод Дюка
Цель работы: научиться определять время кровотечения.
Необходимо для работы: испытуемый, стерильные скарификатор и пинцет, спирт, йод, вата, фильтровальная бумага.
П р о в е д е н и е р а б о т ы:
Проколоть кожу пальца так, чтобы на ее поверхности выступила капля крови.
Каждые 30 с прикладывать фильтрованную бумагу к капле крови (не прикасаясь к ранке).
Отметить, через какое время фильтровальная бумага перестанет впитывать кровь.
В протокол записать ход работы. Полученные результаты сравнить с физиологической нормой. В норме скорость кровотечения по Дюку составляет 2-4 минуты.
РАБОТА №10
Определение группы крови
Цель работы: ознакомиться с принципом определения группы крови и определить ее у одного из студентов.
Необходимо для работы: испытуемый, специальная керамическая (или эмалированная) пластинка с углублениями, стандартные сыворотки I, II, III группы крови, маркированные пипетки, предметное стекло или стеклянные палочки, стерильный скарификатор и пинцет, спирт, вата, йод.
П р о в е д е н и е р а б о т ы:
Нанести на белую керамическую пластинку в углубления при помощи пипетки по большой капле сыворотки (для каждой сыворотки отдельная пипетка) I. II и III групп крови (рис. 4).
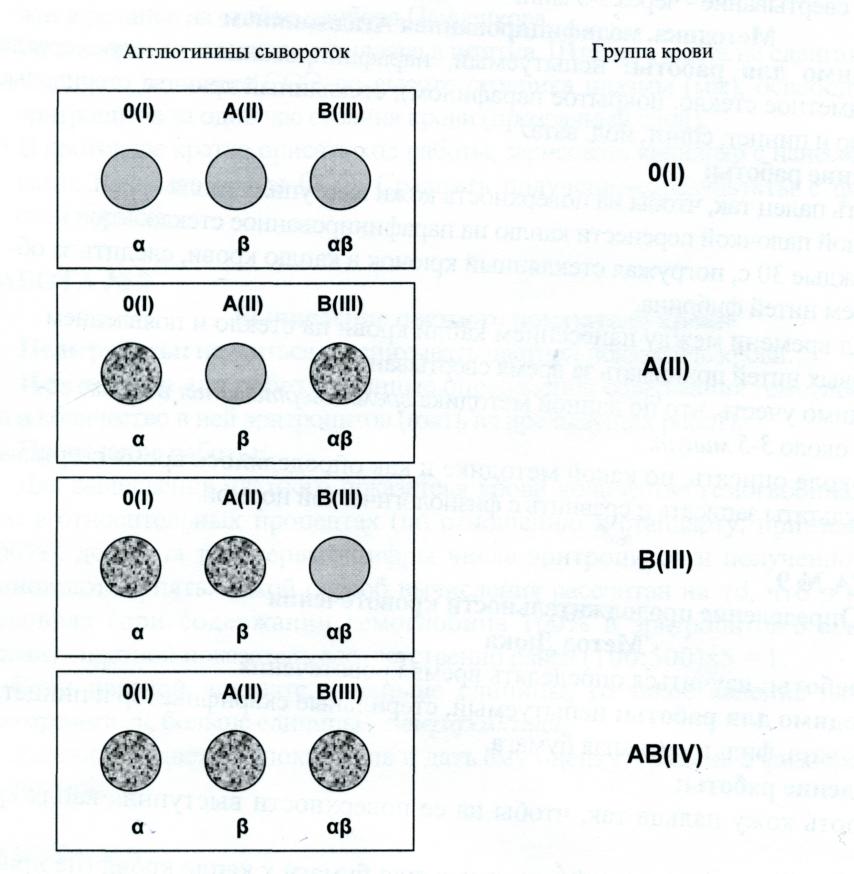
Сделать прокол пальца и добавить в каждую каплю сыворотки каплю крови, перемешать(соотношение сыворотки и крови 10:1). Капли крови с пальца снять разными углами предметного стекла или разными стеклянными палочками (не путать !).
Подождать пять минут, периодически покачивая пластинку, после чего рассмотреть результаты.
Определить по образованию комочков склеенных эритроцитов наличие агглютинации в каждой из капель.
По наличию или отсутствию агглютинации в сыворотках II и III групп крови сделать заключение о наличии или отсутствии в эритроцитах исследуемой крови агглютиногенов А и В. На основании этого дать заключение о групповой принадлежности крови.
По наличию или отсутствию агглютинации эритроцитов исследуемой крови в контрольной стандартной сыворотке I группы проконтролировать правильность определения группы крови.
В протоколе кратко описать ход работы, зарисовать пластинку с результатами агглютинации, сделать вывод о групповой принадлежности исследуемой крови.
РАБОТА №11
Определение резус-принадлежности.
Цель работы: познакомиться с принципом экспресс-методики определения резус-принадлежности крови человека.
Необходимо для работы: Целиклон Анти-Д супер, пипетки, стерильные скарификаторы и пинцет, спирт, иод, вата.
П р о в е д е н и е р а б о т ы:
1. На пластинку со смачиваемой поверхностью нанесите большую каплю (около 0,1 мл.) реагента. Рядом поместите маленькую каплю 0,01-0,05 мл. исследуемой крови и смешайте кровь с реагентом. Наиболее крупная агглютинация наблюдается при использовании эритроцитов в высокой концентрации.
2. Реакция агглютинации начинает развиваться через 10-15 с., четко выраженная агглютинация наступает через 30-60 с. Использование подогретой до 37-40 градусов пластинки сокращает время наступления агглютинации. Результаты реакции учитывайте через 3 мин.
3. По наличию или отсутствию агглютинации сделать заключение о наличии или отсутствии в эритроцитах исследуемой крови резус-агглютиногена.
4. В протоколе кратко описать ход работы, зарисовать наблюдаемую картину и сделать вывод о резус-принадлежности исследуемой крови.
Целиклон Анти-Д супер предназначен для выявления Д антигена системы резус в эритроцитах человека.
Пластинку после смешения реагента с кровью рекомендуется не сразу, а через 20-30 с., что позволяет за это время развиться более полной крупной лепестковой агглютинации.
Контроль специфичности Для контроля специфичности реакции в каждую серию исследуемых эритроцитов необходимо включать стандарты и Д положительные и Д отрицательные эритроциты
ФИЗИОЛОГИЯ ДЫХАНИЯ.
