
- •Раздел 1 общеприкладная медицинская микробиология микробиология как наука
- •История развития микробиологии
- •Систематика и номенклатура микроорганизмов
- •Микроскопические методы исследования микроскопы и способы микроскопии
- •Методы приготовления мазков–препаратов из материала (культур) и способы их окрашивания
- •Морфология и ультраструктура прокариот эубактерии
- •Патогенные спирохеты
- •Актиномицеты
- •Риккетсии
- •Микоплазмы
- •Физиология микроорганизмов
- •Выделение чистых культур бактерий
- •Выделение и изучение культуральных свойств бактерий–аэробов
- •Особенности выделения и изучения культуральных свойств бактерий–анаэробов
- •Действие физических, химических и биологических факторов на микроорганизмы
- •Бактериофаги (фаги)
- •Стерилизация
- •Инфекция
- •Механизмы неспецифической резистентности
- •Антигены как индукторы приобретенного антимикробного иммунитета
- •Органы иммунитета и иммунокомпетентные клетки
- •Антитела (иммуноглобулины)
- •Процесс антителообразования
- •Аллергия (гиперчувствительность)
- •Патогенез и характер проявления анафилаксии и инфекционной аллергии
- •Иммунопрофилактика и иммунотерапия вакцины
- •Иммунные сыворотки (гамма–глобулины)
- •Серологические реакции иммунитета
- •Реакция агглютинации
- •Реакция преципитации
- •Реакция связывания комплемента
- •Реакция иммунофлюоресценции
- •Реакция торможения гемагглютинации
- •Раздел 2 инфекционная микробиология возбудители бактериальных инфекций пиогенные кокки
- •Общая характеристика патогенных энтеробактерий и вызываемых ими кишечных инфекций
- •Эшерихии
- •Возбудители брюшного тифа и паратифов а и в
- •Возбудители сальмонеллезов
- •Возбудители дизентерии
- •Холерный вибрион
- •Коринебактерии дифтерии
- •Возбудители туберкулеза и микобактериозов
- •Возбудитель сифилиса
- •Возбудители вирусных инфекций общая характеристика вирусов
- •Вирусы гриппа
- •Вирусы парагриппа
- •Аденовирусы
- •Вирусы гепатита
- •Спид и спид–ассоциированные инфекции
- •Возбудители протозойных болезней плазмодии малярии
- •Токсоплазмы
- •Трихомонады
- •Лямблии
- •Приложение устройство, оснащение и правила работы в микробиологических лабораториях
- •Раздел 1 1
- •Раздел 2 62
Антитела (иммуноглобулины)
V–область
с паратопами
С–область
Рис.
27 Строение
иммуноглобулина G
Fc–
фрагмент
Рис.
28 Классы
иммуноглобулинов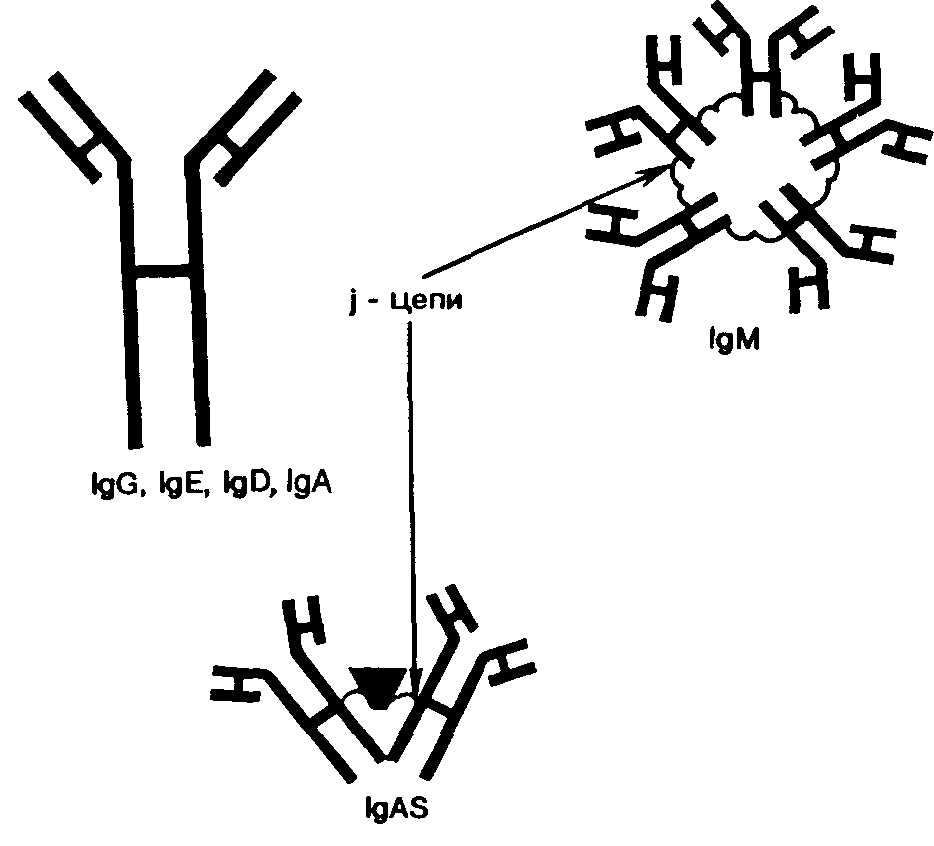
Классы. В зависимости от строения константных областей тяжелых цепей все иммуноглобулины разделяют на пять классов: IgG, IgЕ, IgD, IgМ и IgА (рис. 28). Первые три класса иммуноглобулинов являются мономерами, т. е. бивалентными, содержащими два антигенсвязывающих центра. IgМ – полимер, состоит из пяти мономерных молекул, связанных в области Ре–фрагментов особыми/–цепями. Валентность IgА различна. В сыворотке крови IgА, как и IgG, имеет мономерную структуру, а в секретах слизистых оболочек, межтканевой жидкости – в виде димеров (двух мономерных молекул). Эти так называемые секреторные IgАS связаны особым полипептидом, который защищает димеры от воздействия протеолитических ферментов.
Физико–химические свойства Ig. По физико–химическим свойствам иммуноглобулины G, Е, D и А представляют собой белки с молекулярной массой 150 000–350 000, обозначаемые по константе седиментации как 7S (IgG, IgЕ, IgD, IgА), 7,7–8,0 S (IgА), 9–12 S (IgAS). Макроиммуноглобулины М имеют молекулярную массу 900000 и константу седиментации 19 S.
Биологические свойства Ig. Касаясь биологических свойств иммуноглобулинов, нужно отметить, что содержание их в крови непостоянно и колеблется от 0,3–0,4 мг% (IgE) до 50–420 мг% (IgА и IgМ) и 800–1680 мг% (IgG).
На первичное введение в организм антигена вырабатываются IgM. Отличаются они выраженной авидностью (жадностью), т. е., обладая 10 антигенсвязывающими центрами, образуют прочные соединения с антигенами, несущими множественные эпитопы, вызывают агглютинацию и лизис клеток, обеспечивают устойчивость к бактериальным инфекциям. Сохраняются IgМ, однако, недолго, и период их полувыведения не превышает 5 дней.
При повторном попадании антигена происходит бурная выработка IgG, обеспечивающих нейтрализацию бактериальных токсинов и вирусов. Связываясь с микроорганизмами, IgG активируют образование комплемента, вызывают хемотаксис нейтрофилов. Микрофаги быстро поглощают бактерии, обработанные IgG и комплементом, так как имеют рецепторы к Fc–фрагменту иммуноглобулина и С3–фракции комплемента. IgG легко проникает через барьеры, в частности сквозь плаценту, попадая в кровь новорожденных. В последующем титр их пополняется при кормлении грудью, что обеспечивает иммунитет младенца в первые недели жизни. Период полувыведения IgG равен 24 дням.
Иммуноглобулины А, AS, Е вырабатываются как на первичное, так и на вторичное воздействие антигена. При этом сывороточные IgА накапливаются в крови. Секреторные IgAS продуцируются в слизистых оболочках кишечника, верхних дыхательных и мочевыводящих путей, содержатся в глазной жидкости, слюне, молоке и обеспечивают местный иммунитет тканей. Период полувыведения равен 6 дням.
IgE – цитофильный иммуноглобулин, в частности связывается с тучными клетками и базофилами крови. При реагировании с антигенами (микробами, веществами) в результате образования на их поверхности иммунных комплексов высвобождаются медиаторы воспалительной реакции.
Иммуноглобулин класса D находится на поверхности В– лимфоцитов и вместе с мономерными IgМ составляет их рецепторы.
Взаимодействие иммуноглобулинов с антигенами. IgG, IgM, IgA реагируют с детерминантами антигенов всеми имеющимися в их молекуле антигенсвязывающими центрами. Вследствие этого в растворах образуются крупные конгломераты веществ. Антитела, вызывающие видимые реакции, называют полными. В противоположность этому некоторая часть IgЕ и IgG реагирует с антигеном лишь одним активным центром, видимых реакций не дает и поэтому называется неполными антителами. Если реакция взаимодействия этих антител происходит в крови и не вызывает каких–либо нарушений в организме, их называют антителами–свидетелями. Последние блокируют антиген, а нередко одновременно связывают комплемент, вследствие чего называются блокирующими и комплементсвязывающими. Реагирование IgE с антигенами на поверхности клеток приводит к развитию аллергий. При незначительных, бесследно исчезающих проявлениях аллергии на кожных покровах антитела называют реагинами, а при ярко выраженных повреждениях клеток кожи –агрессинами или кожно–сенсибилизирующими антителами.
