
- •Вопросы безопасности
- •Общий план подготовки для учителей
- •Подготовка преподавателей к лабораторной работе
- •Приготовьте жидкую питательную среду
- •Разлейте жидкую питательную среду
- •Промотор – участок днк, с которого начинается транскрипция мРнк. Активация транскрипции с какого-либо промотора в конечном итоге приводит к синтезу белка. См. Приложение d
- •Ночные жидкие культуры
- •Урок 5 Третья стадия очистки: хроматография белка
- •Гидрофобная хроматография
- •Нанесение содержащего gfp супернатанта на колонку
- •Удалось ли вам успешно выделить и очистить зеленый флуоресцентный белок из клонированных бактериальных клеток? Обоснуйте ваш ответ.
- •Экспериментальный протокол к уроку 3
- •Вопросы к уроку 3
- •Урок 4 Вторая стадия очистки: удаление бактериального дебриса
- •Экспериментальный протокол для урока 4
- •Вопросы к уроку 5
- •Линейный код, трехмерные последствия
- •Гены это отдельные «файлы» генетической информации
- •Плазмиды это маленькие кольцевые молекулы днк
- •Библиотеки днк
Урок 5 Третья стадия очистки: хроматография белка
Хроматография это мощное средство разделения белков в составе сложных смесей. Внутри бактериальной клетки содержатся тысячи разных белков, от которых нужно отделить GFP. Для хроматографии используется колонка (цилиндр), заполненная сорбентом (микроскопическими шариками). Эти шарики образуют массу наподобие песка, через которую должен просочиться раствор белка. Если посчитать суммарную площадь поверхности сорбента, она окажется огромной. Сорбент, который используется в данной задаче, имеет особое «сродство» к GFP, в отличие от всех остальных белков, содержащихся в клетке. GFP буквально «прилипает» к колонке, что позволяет отделить его от остальных белков.
Гидрофобные («боящиеся воды») вещества (например, жиры) плохо смешиваются с водой. Когда они попадают в соленую воду (где меньше концентрация молекул воды), они стремятся слипнуться друг с другом. Некоторые из аминокислот в составе белка очень гидрофобные. В соленой воде они стремятся прилипнуть к другим гидрофобным молекулам. При высокой концентрации соли трехмерная структура белка изменяется таким образом, что гидрофобные остатки оказываются снаружи, а гидрофильные («любящие воду») участки оказываются больше «спрятаны» внутри (так как чем больше соли, тем меньше воды, с которой они взаимодействуют).
Колонка для гидрофобной хроматографии заполнена гидрофобным сорбентом. Когда образец в соленой воде наносится на колонку, гидрофобные белки в составе образца «прилипают» к сорбенту. Чем выше степень гидрофобности, тем сильнее взаимодействие. Когда соль удаляется, пространственная структура белка меняется обратно, так что гидрофобные участки оказываются внутри, а гидрофильные – снаружи. В результате гидрофобные белки отлипают от сорбента и вытекают из колонки, будучи отделенными от остальных белков.
Гидрофобная хроматография
На протяжении уроков 4 и 5 растворимый GFP из супернатанта очищается с помощью гидрофобной хроматографии. GFP содержит несколько участков, состоящих из гидрофобных аминокислот, в результате чего общая гидрофобность белка оказывается очень высокой. Когда супернатант, содержащий большое количество GFP протекает через колонку в буферном растворе с высокой коцентрации соли (буфер для связывания) гидрофобные участки в составе GFP связываются с сорбентом. Другие, менее гидрофобные (или если хотите, более гидрофильные) белки протекают сквозь колонку, не задерживаясь. Эта простая процедура позволяет выделить зеленый флуоресцентный белок из сложной смеси бактериальных белков.
Нанесение содержащего gfp супернатанта на колонку
Когда ученики наносят содержащий GFP супернатант на колонку, важно проследить за тем, чтобы они не взмучивали поверхность сорбента, она должна быть сравнительно плоской. Небольшие неровности не окажут большого влияния на процесс; тем не менее, во время нанесения, промывки и элюции с колонки сорбент должен как можно меньше взмучиваться и смешиваться с буфером. Во время нанесения супернатанта на колонку, пипетка вносится в колонку и супернатант медленно выливается вдоль стенки. Когда супернатант полностью зашел в колонку, под УФ верхней части сорбента должно быть видно зеленое кольцо.
Во время процедуры хроматографии используются четыре разных буфера ,и каждый из них должен медленно наноситься вдоль стенки, чтобы не повредить поверхность сорбента.
Буфер для уравновешивания
Буфер, содержащий среднее количество соли (2М (NH4)2SO4 который используется чтобы «уравновесить» или «подготовить» колонку перед связыванием GFP.
Буфер для связывания
Равное количество буфера для связывания (4 М (NH4)2SO4 добавляется к содержащему GFP бактериальному лизату, в результате чего GFP оказывается в растворе с такой же концентрацией соли, как и уравновешенная колонка (2 М). В растворе соли гидрофобные участки белка оказываются снаружи и могут взаимодействовать с гидрофобной поверхностью сорбента.
Буфер для промывки
Буфер со средней концентрацией соли (1.3 М (NH4)2SO4 ), который используется для того, чтобы отмыть слабо связавшиеся белки от колонки. Зеленый флуоресцентный белок очень гидрофобный и остается связанным с колонкой. Добавлять промывочный буфер нужно очень аккуратно, чтобы минимизировать взмучивание сорбента.
Буфер для элюции
Это буфер с низкой концентрацией соли (ТЕ, 10mM Tris/EDTA) который используется чтобы смыть GFP от колонки. В растворах с низкой концентрацией соли (где выше концентрация молекул воды) структура GFP изменяется так, что гидрофильные («любящие воду») участки оказываются на поверхности, в результате чего GFP приобретает большее сродство к буферу, чем к сорбенту и «отлипает» от него. На колонку аккуратно как описано выше наносится 750 мкл буфера ТЕ. Буфер ТЕ разрушает гидрофобные взаимодействия между GFP и сорбентом, и GFP смывается с колонки («элюируется»). GFP должен перемещаться вниз по колонке как видимое под УФ ярко-зеленое кольцо. Если поверхность сорбента была нарушена на предыдущих шагах, GFP не будет выглядеть как ровное кольцо, и будет элюироваться в более размытой форме. Тем не менее, он все равно смоется с колонки. В случае успеха пробирка для сбора фракций #3 должна светиться ярко-зеленым под УФ.
Хранение пробирок
Все пробирки для сбора фракций вместе с их содержимым можно закрыть или накрыть пленкой и хранить в холодильнике 1-2 недели.
Подсказки для успешной хроматографии:
Не старайтесь очень глубоко засунуть колонку в пробирку для сбора фракций. Если слишком стенки колонки слишком плотно прижмутся к пробирке, это создаст воздушную пробку и колонка не будет течь. Вы можете сделать опору из бумажки, свернув кусочек бумаги до размера спички и просунув его между колонкой и стенкой пробирки. Это застрахует вас от образования воздушной пробки и гарантирует что колонка будет течь
Скорость течения колонки на этапе элюции можно увеличить, если плотно закрыть колонку сверху крышкой. Это создаст давление воздуха, которое заставить жидкость течь сквозь колонку быстрее.
Колонки рассчитаны на то, чтобы течь медленно. Полная процедура хроматографии должна занять от 20 до 30 минут. Важно не перемещать колонку из пробирки в пробирку больше чем это необходимо, так как это может взбалтывать сорбент.
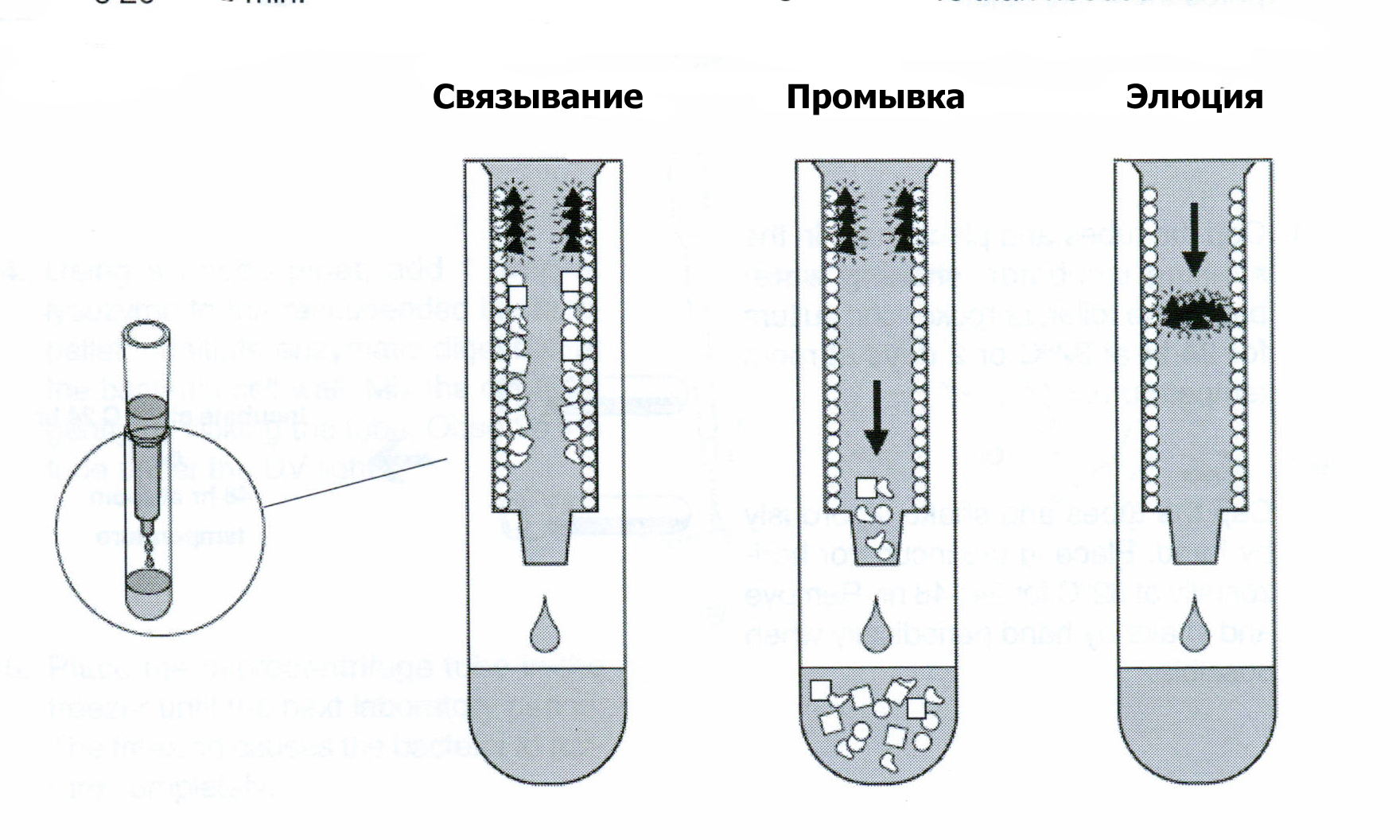
Очистка GFP - краткое руководство в картинках
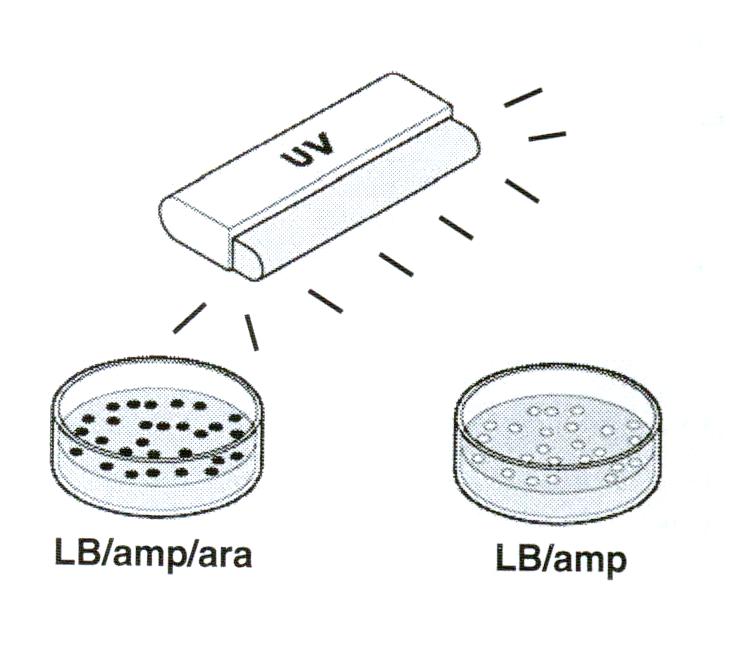
Урок 2 Инокуляция и выращивание
бактериальных культур
Выньте чашки с трансформантами
из термостата и рассмотрите под ультрафиолетом.
Найдите несколько изолированных зеленых колоний на чашке LB/amp/ara
и несколько изолированных белых колоний на чашке LB/amp
В
 озьмите
две культуральные пробирки, содержащую
среду
озьмите
две культуральные пробирки, содержащую
среду
LB/amp/ara. Обозначьте одну «+», и другую «-». Используя стерильную петлю,
осторожно коснитесь петлей зеленой колонии и опустите ее в пробирку, обозначенную «+». Используя другую стерильную петлю, повторите процедуру для белой колонии, и опустите в пробирку с надписью «-». Очень важно взять материал из одной изолированную колонии и не затронуть петлей другие. Покрутите петлю между большим и указательным пальцами, чтобы суспендировать колонию в пробирке.
З
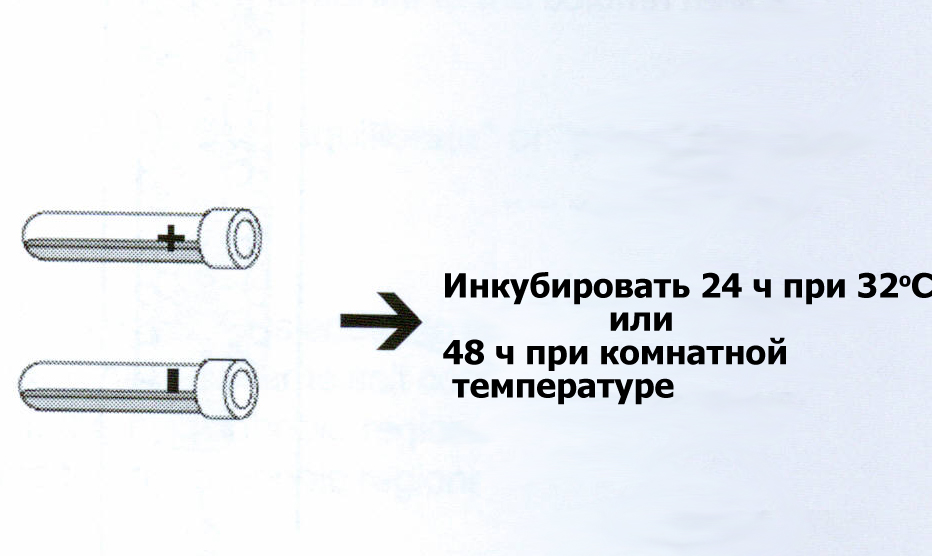 акройте
пробирки крышками и поместите их на
качалку или шейкер на 24 часа при 32º или
на двое суток при комнатной температуре.
акройте
пробирки крышками и поместите их на
качалку или шейкер на 24 часа при 32º или
на двое суток при комнатной температуре.
или
Закройте пробирки и интенсивно потрясите руками. Поместите в горизонтальном положении в термостат на 32º на 24-48 часов.
Во время инкубации по мере возможности вытаскивайте и встряхивайте пробирки.
Урок 3 Первая стадия очистки
К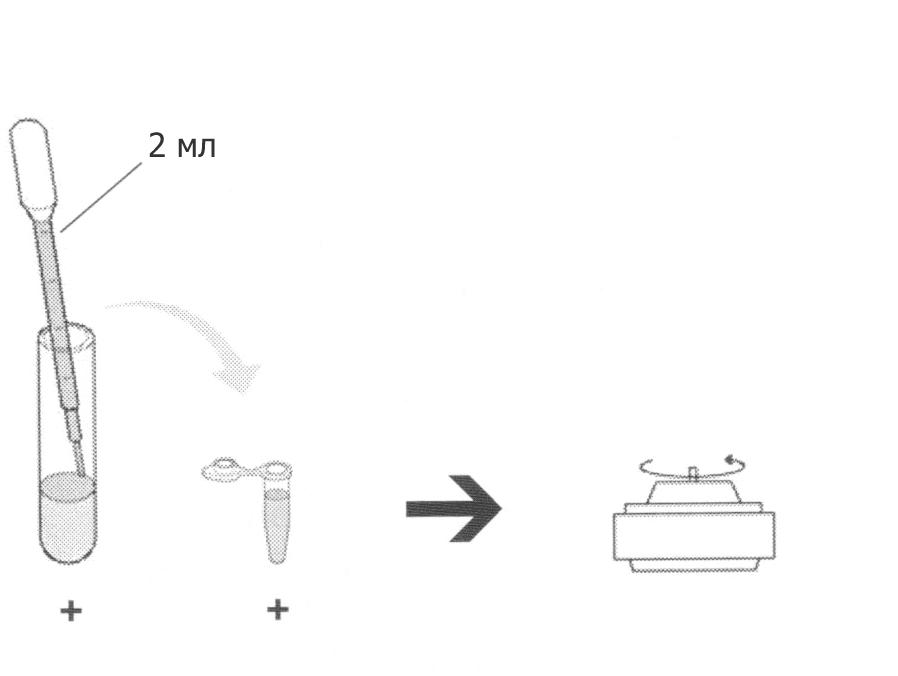 онцентрирование
бактерий
онцентрирование
бактерий
Подпишите микроцентрифужную пробирку «+» и вашим именем. Выньте ваши жидкие культуры из термостата и посмотрите под ультрафиолетом. Обратите внимание на какую-либо разницу в цвете. Возьмите чистую пипетку и перенесите 2 мл культуры из культуральной пробирки с надписью «+» в подписанную микроцентрифужную пробирку. Открутите пробирку в центрифуге 5 минут на максимальной скорости. На этом этапе можно использовать одну и ту же пипетку на всех шагах, промывая ее водой в стакане.
Вылейте супернатант и посмотрите на осадок под УФ.
И
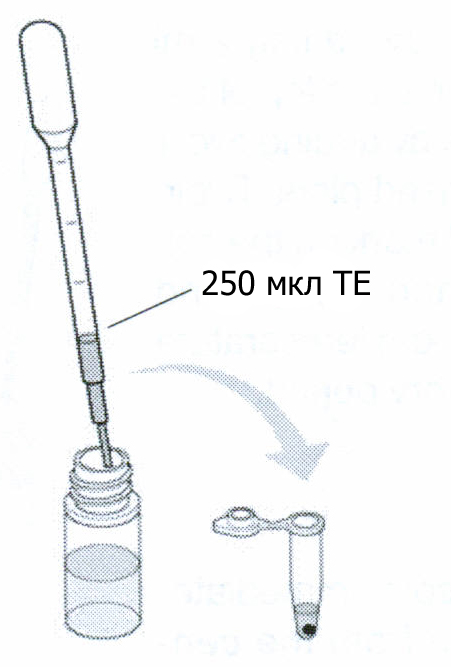 спользуя
промытую пипетку, добавьте 250 мкл ТЕ в
пробирку. Тщательно ресуспендируйте
осадок, пипетируя раствор в пробирке
(гоняя жидкость в пипетке)
спользуя
промытую пипетку, добавьте 250 мкл ТЕ в
пробирку. Тщательно ресуспендируйте
осадок, пипетируя раствор в пробирке
(гоняя жидкость в пипетке)
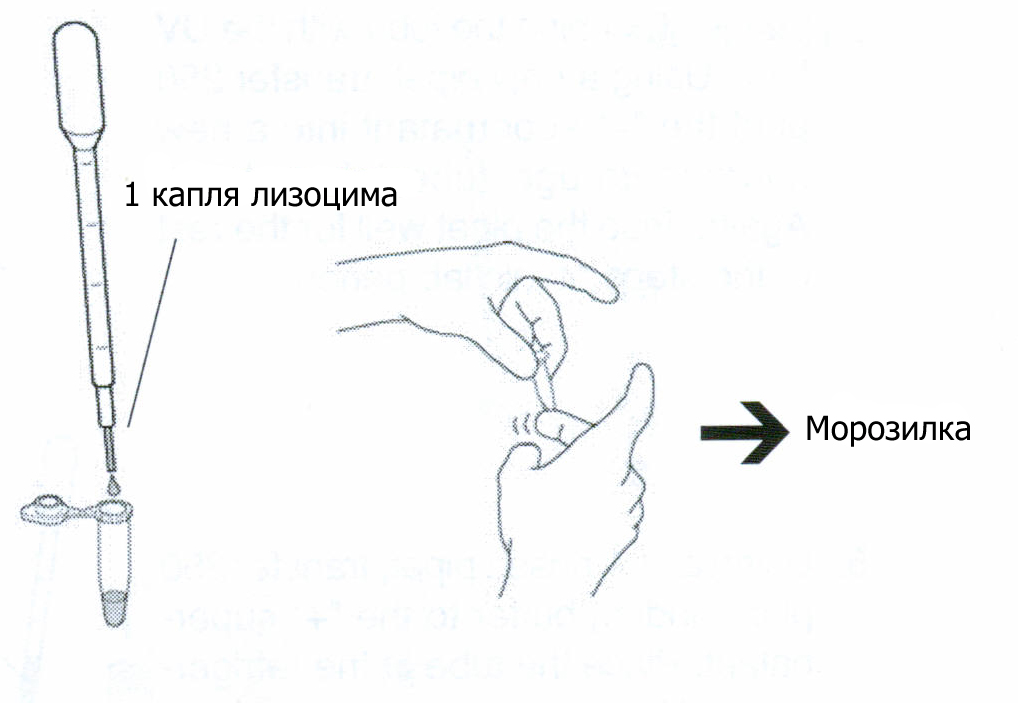
Используя промытую пипетку, добавьте 1 каплю лизоцима к ресуспендированным клеткам, чтобы начать ферментативное расщепление клеточных стенок. Аккуратно перемешайте содержимое, встряхивая пробирку пальцем. Пронаблюдайте за происходящим в пробирке под УФ.
Поместите микроцентрифужную пробирку в морозилку до следующего этапа работы. Замораживание-оттаивание полностью разрушит бактериальные клетки.
Урок 4 Вторая стадия очистки
Л изис
бактерий
изис
бактерий
В
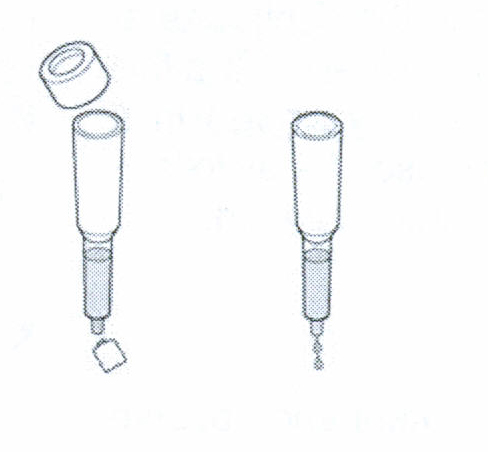 ыньте
микроцентрифужную пробирку из
морозильника и оттайте в руках. Осадите
бактериальный дебрис, открутив пробирку
в центрифуге 10 минут на максимальной
скорости.
ыньте
микроцентрифужную пробирку из
морозильника и оттайте в руках. Осадите
бактериальный дебрис, открутив пробирку
в центрифуге 10 минут на максимальной
скорости.
Пока пробирка центрифугируется, подготовьте колонку для хроматографии. Снимите верхнюю крышку и отломите нижнюю. Пусть вся жидкость вытечет из колонки, это займет 3-5 мин.
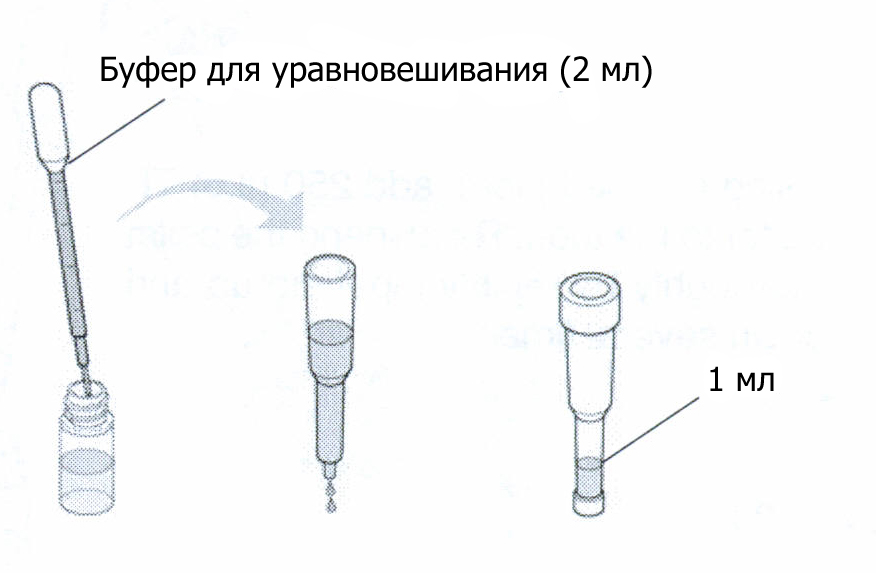
Уравновесьте колонку, осторожно добавив 2 мл буфера для уравновешивания на поверхность сорбента. Это делается двумя порциями по 1 мл промытой пипеткой. Позвольте буферу стечь до отметки 1 мл, после чего закройте колонку сверху и снизу и сохраняйте ее при комнатной температуре до следующего занятия.
С
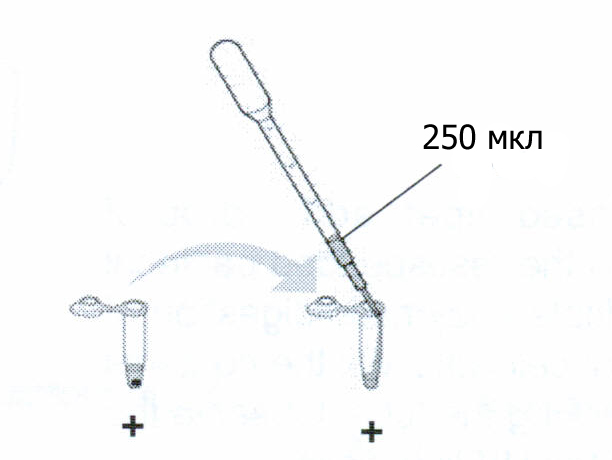 разу
же после окончания 10-минутного
центрифугирования выньте вашу пробирку
из центрифуги. Посмотрите на пробирку
под ультрафиолетом. Взяв новую пипетку,
осторожно перенесите 250 мкл супернатанта
в чистую микроцентрифужную пробирку,
подписанную «+». Хорошо промойте пипетку
для последующих шагов этого этапа.
разу
же после окончания 10-минутного
центрифугирования выньте вашу пробирку
из центрифуги. Посмотрите на пробирку
под ультрафиолетом. Взяв новую пипетку,
осторожно перенесите 250 мкл супернатанта
в чистую микроцентрифужную пробирку,
подписанную «+». Хорошо промойте пипетку
для последующих шагов этого этапа.
Хорошо промытой пипеткой добавьте 250 мкл буфера для связывания к отобранному супернатанту. Поместите пробирку в холодильник до следующего занятия.
Урок 5 Третья стадия очистки
Х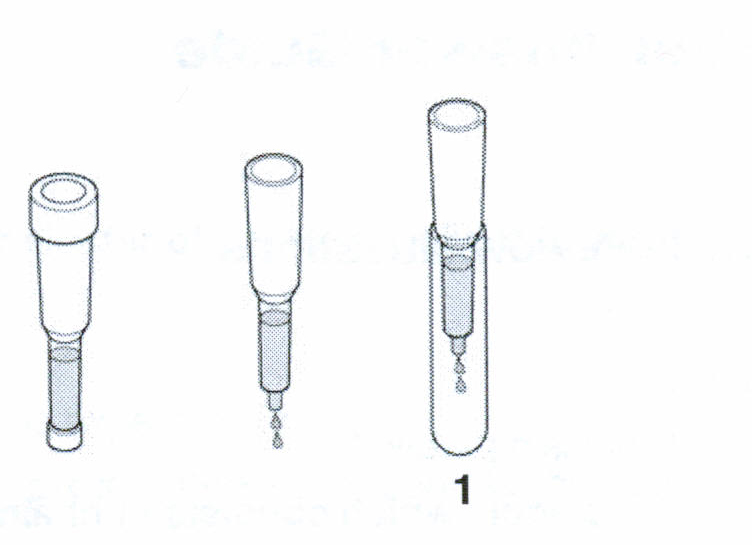 роматография
белка
роматография
белка
В
 озьмите
три пробирки для сбора фракций, обозначьте
их цифрами от 1 до 3 и поставьте в штатив,
(или воткните в кусочек пенопласта).
Снимите верхнюю и нижнюю крышки с
колонки и поместите ее внутрь первой
пробирки для сбора фракций. Излишки
буфера будут вытекать, дождитесь, пока
верхняя граница буфера не дойдет до
верхней границы слоя сорбента.
озьмите
три пробирки для сбора фракций, обозначьте
их цифрами от 1 до 3 и поставьте в штатив,
(или воткните в кусочек пенопласта).
Снимите верхнюю и нижнюю крышки с
колонки и поместите ее внутрь первой
пробирки для сбора фракций. Излишки
буфера будут вытекать, дождитесь, пока
верхняя граница буфера не дойдет до
верхней границы слоя сорбента.
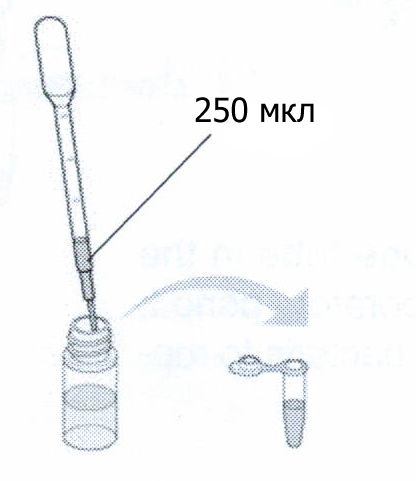
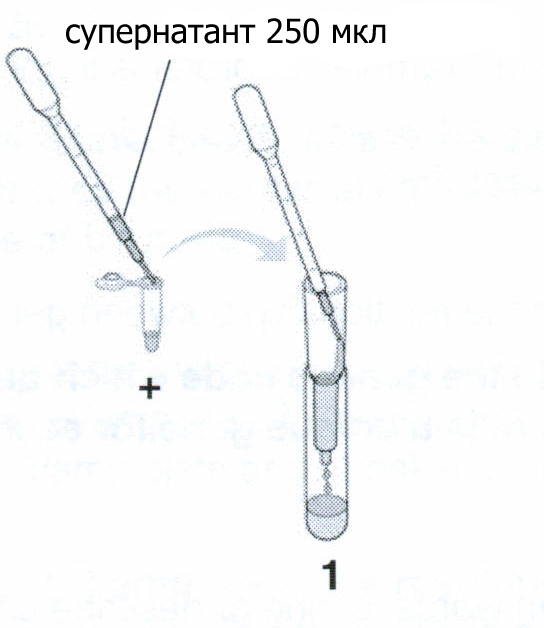
Возьмите новую пипетку и очень медленно и аккуратно налейте 250 мкл содержащего GFP супернатанта на поверхность сорбента. Держите кончик пипетки у стенки колонки, так чтобы образец тек вдоль стенки и поверхность сорбента оставалось как можно более ровной. Посмотрите на колонку под ультрафиолетом. Запишите ваши наблюдения. После того как с колонки перестанет капать, переместите ее в пробирку для сбора фракций #2
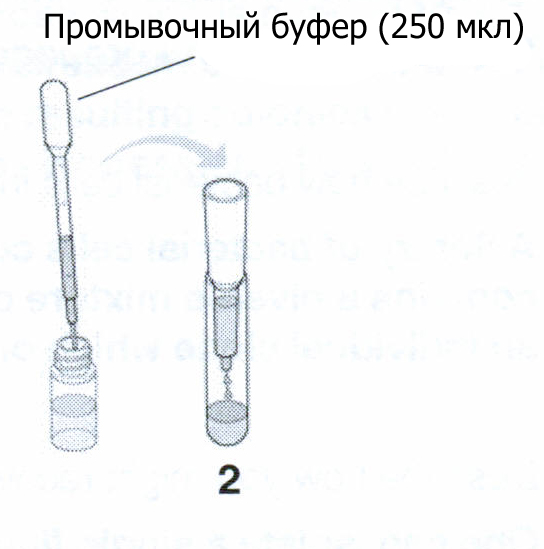
Используя промытую пипетку, добавьте 250 мкл промывочного буфера. Колонка снова начнет течь. Посмотрите на нее под ультрафиолетом и запишите ваши наблюдения. Когда колонка полностью протечет, переместите ее в пробирку #3
Используя промытую пипетку, нанесите на колонку 750 мкл буфера ТЕ. Наблюдайте за процессом под ультрафиолетом. Запишите ваши наблюдения.
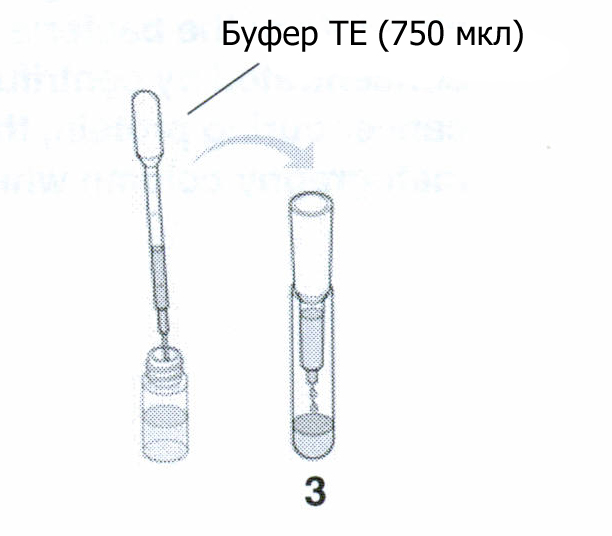
Осмотрите все три пробирки для сбора фракций и обратите внимание на разницу в цвете. Закройте пробирки или замотайте пленкой и сохраняйте в холодильнике до следующего занятия.
Ответы на вопросы для преподавателей
Ответы на вопросы к уроку 1
Белки
А. Что такое белок?
Макромолекула, состоящая из цепи аминокислот
Б. Приведите три примера белков в составе вашего тела
Антитела, пищеварительные ферменты, белок в составе волос и ногтей (кератин), гормоны, гемоглобин – это все белки
В. Объясните взаимосвязь между генами и белками
Последовательность гена определяет аминокислотный состав белка. Каждый белок во всех клетках нашего тела кодируется одним единственным уникальным геном.
Объясните своими собственными словами, что такое «клонирование»
Дупликация и размножение клетки или организма, содержащих идентичный генетический материал.
Объясните чем бактериальные клетки в «библиотеке» отличаются от клеток в одной колонии
«Библиотека» бактериальных клеток содержит смесь разных генотипов, содержащих разные гены. Клетки в одной колонии генетически идентичны, так как являются копиями одной исходной клетки.
Опишите, как бы вы могли выделить белок, излечивающий от рака, из бактерий.
Мы могли бы изолировать одиночную колонию на чашке, и вырастить большое количество бактерий в жидкой культуре. Бактерии из жидкой культуры можно сконцентрировать центрифугированием. После этого бактерии надо лизировать, чтобы нужный нам белок оказался в растворе. Затем можно очистить белок с помощью хроматографической колонки, имеющий сродство к данному белку.
Ответы на вопросы к уроку 2
Что такое колония бактерий?
Бактериальная колония это группа клеток, произошедшая от одной клетки.
Зачем в работе нужно следующее оборудование:
А. УФ лампа
Зеленый флуоресцентный белок флуоресцирует и становится видимым, когда поглощает ультрафиолетовый свет
Б.Термостат
Термостат создает температуру, благоприятную для роста бактерий
В. Качалка
Качалка создает благоприятную температуру и обеспечивает хорошую аэрацию культуры. Хорошее снабжение кислородом ускоряет рост клеток.
Предположите ,что произойдет если вы возьмете одну из зеленых колоний с чашки LB/amp/ara и пересеете ее на чашку LB/amp? И наоборот, что произойдет если вы возьмете белую колонию с чашки LB/amp и пересеете ее на чашку LB/amp/ara? Объясните ваш ответ.
Если зеленую колонию пересеять на чашку LB/amp, выросшие колонии будут белыми, т.к. среда не содержит арабинозы, необходимой для включения гена зеленого флуоресцентного белка. Если пересеять белую колонию на чашку LB/amp/ara, колонии будут зелеными, потому что в среде есть арабиноза, которая индуцирует экспрессию GFP.
Объясните, как помещение клонированных клеток в питательную среду связано с вашей общей целью выделения GFP.
Для выделения белка нужно нарастить достаточное количество биомассы бактерий. Для этого бактерии выращивают в жидкой среде; чем больше объем среды, тем больше будет биомасса и тем большее количество белка можно будет выделить.
Ответы на вопросы к уроку 3
Вы используете бактерий, чтобы наработать зеленый флуоресцентный белок. Назовите функцию оборудования и материалов, которые вы использовали на уроке 3
А. Центрифуга – Используется, чтобы осадить бактериальные клетки и отделить их от среды.
Б. Лизоцим – Используется для ферментативного расщепления бактериальной клеточной стенки, после чего она становится хрупкой и рвется при замораживании.
В. Морозильная камера – Замораживание приводит к увеличению объема цитоплазмы, в результате чего клеточная стенка и мембрана рвутся.
Объясните, почему обе («+» и «-») жидкие культуры флуоресцируют зеленым под ультрафиолетом?
Культура, выращенная из зеленой колонии, посеянной в пробирку с надписью «+» светится зеленым, потому что арабиноза, содержащаяся в жидкой среде, продолжает индуцировать экспрессию гена GFP. Культура, выращенная из белой колонии, посеянной в пробирку с надписью «+» также светится зеленым, потому что содержащаяся в среде арабиноза включает работу гена GFP, который был выключен, когда клетки росли на чашке LB/amp без арабинозы.
Почему вы отбросили супернатант на этой стадии очистки белка?
Потому что супернатант состоит из среды выращивания и не содержит GFP.
4. Объясните, почему бактериальная клеточная стенка рвется при замораживании. (подсказка: что происходит с закрытой бутылкой воды, если ее заморозить?)
Лед занимает больший объем, чем вода. Когда бактериальная клетка замерзает, объем цитоплазмы увеличивается. Это создает давление на клеточную стенку, и она лопается.
Какова цель разрушения, или лизиса бактерий?
Бактерии необходимо разрушить, чтобы высвободить находящийся в цитоплазме GFP, который далее может быть очищен с помощью хроматографии.
Ответы на вопросы к уроку 4
Какого цвета был осадок на этой стадии эксперимента? Какого цвета был супернатант? О чем это вам говорит?
Осадок должен быть белого или бледно-зеленого цвета. Супернатант должен ярко светиться зеленым. Цвет сигнализирует о том, что зеленый флуоресцентный белок высвободился из клеток и остался растворен в супернатанте. Гораздо более бледный цвет осадка говорит о том, что большая часть GFP высвобождается из клеток.
Почему вы отбрасываете осадок на этой стадии?
Осадок содержит нежелательные компоненты – куски клеточной стенки, мембраны, хромосомную ДНК. В нем совсем мало или вовсе нет GFP и его можно отбросить.
Кратко опишите суть хроматографии белка и объясните ее назначение в этой работе.
Хроматография белка это метод отделения интересующего нас белка от других молекул. Он основан на разном сродстве белков к сорбентам, через которые они протекают. GFP обладает ярко выраженными гидрофобными свойствами, что позволяет отделить его от других белков с помощью гидрофобной хроматографии.
Ответы на вопросы к уроку 5
Перечислите ваши предсказания и наблюдения за образцом, при добавлении к нему различных буферов для хроматографии.
Номер пробирки для сбора фракций |
Предсказания |
Наблюдения за колонкой и пробиркой под УФ |
#1 Колонка в буфере для связывания |
GFP должен связываться с колонкой |
GFP виден как зеленое кольцо в верхней части колонки |
#2 Колонка в промывочном буфере |
GFP должен оставаться связанным с колонкой |
GFP остается на колонке в виде широкой полосы |
#3 Колонка в буфере для элюции |
GFP должен смываться (элюироваться) с колонки |
GFP в виде кольца перемещается вниз по колонке и вытекает в пробирку 3 |
Используя заполненную таблицу, сравните совпали ли ваши предсказания с наблюдаемыми результатами для каждого буфера.
А. Буфер для связывания – GFP связывается с колонкой
Б. Промывочный буфер – GFP остается связанным с колонкой
В. Буфер для элюции – GFP элюируется с колонки
Основываясь на своих результатах, объясните назначение каждого буфера. (подсказка: названия буферов говорят сами за себя)
А. Буфер для уравновешивания – Этот буфер готовит колонку для нанесения образца, содержащего GFP. Этот буфер содержит такую же концентрацию соли, как и содержащий GFP супернатант (после добавления туда буфера для связывания)
Б. Буфер для связывания – Это буфер с высоким содержанием соли. Соль заставляет GFP изменить свою конформацию так, что гидрофобные участки оказываются снаружи.
В. Буфер для промывки – Служит для того чтобы смыть менее гидрофобные и менее прочно связанные с колонкой белки
Г. Буфер для элюции (TE) – Снимает GFP с колонки.
В каких буферах высокая концентрация соли, а в каких низкая? Почему должно быть именно так?
Буфер для связывания>>Буфер для уравновешивания>>Буфер для промывки>>Буфер для элюции
Буфер для связывания содержит самую высокую концентрацию соли. Это нужно, чтобы поднять концентрацию соли в бактериальном лизате, содержащем GFP. В этих условиях обнажаются гидрофобные участки белка, способные взаимодействовать с колонкой. Буфер для уравновешивания должен содержать такое же количество соли, как и наносимый на колонку материал; так как буфер для связывания разводится в два раза при добавлении к супернатанту, в буфере для уравновешивания в два раза меньше соли. Буфер для промывки служит для того, чтобы удалить случайно связавшиеся примеси, он содержит немного меньше соли. Буфер для элюции TE содержит самую низкую концентрацию соли, потому что он служит для того, чтобы снять GFP с колонки. В условиях низкой соли на поверхности белка оказываются только гидрофильные аминокислотные остатки, а отвечающие за взаимодействие с сорбентом гидрофобные оказываются спрятаны.
