- •Вопросы безопасности
- •Общий план подготовки для учителей
- •Подготовка преподавателей к лабораторной работе
- •Приготовьте жидкую питательную среду
- •Разлейте жидкую питательную среду
- •Промотор – участок днк, с которого начинается транскрипция мРнк. Активация транскрипции с какого-либо промотора в конечном итоге приводит к синтезу белка. См. Приложение d
- •Ночные жидкие культуры
- •Урок 5 Третья стадия очистки: хроматография белка
- •Гидрофобная хроматография
- •Нанесение содержащего gfp супернатанта на колонку
- •Удалось ли вам успешно выделить и очистить зеленый флуоресцентный белок из клонированных бактериальных клеток? Обоснуйте ваш ответ.
- •Экспериментальный протокол к уроку 3
- •Вопросы к уроку 3
- •Урок 4 Вторая стадия очистки: удаление бактериального дебриса
- •Экспериментальный протокол для урока 4
- •Вопросы к уроку 5
- •Линейный код, трехмерные последствия
- •Гены это отдельные «файлы» генетической информации
- •Плазмиды это маленькие кольцевые молекулы днк
- •Библиотеки днк
РПромотор – участок днк, с которого начинается транскрипция мРнк. Активация транскрипции с какого-либо промотора в конечном итоге приводит к синтезу белка. См. Приложение d
егуляция генов
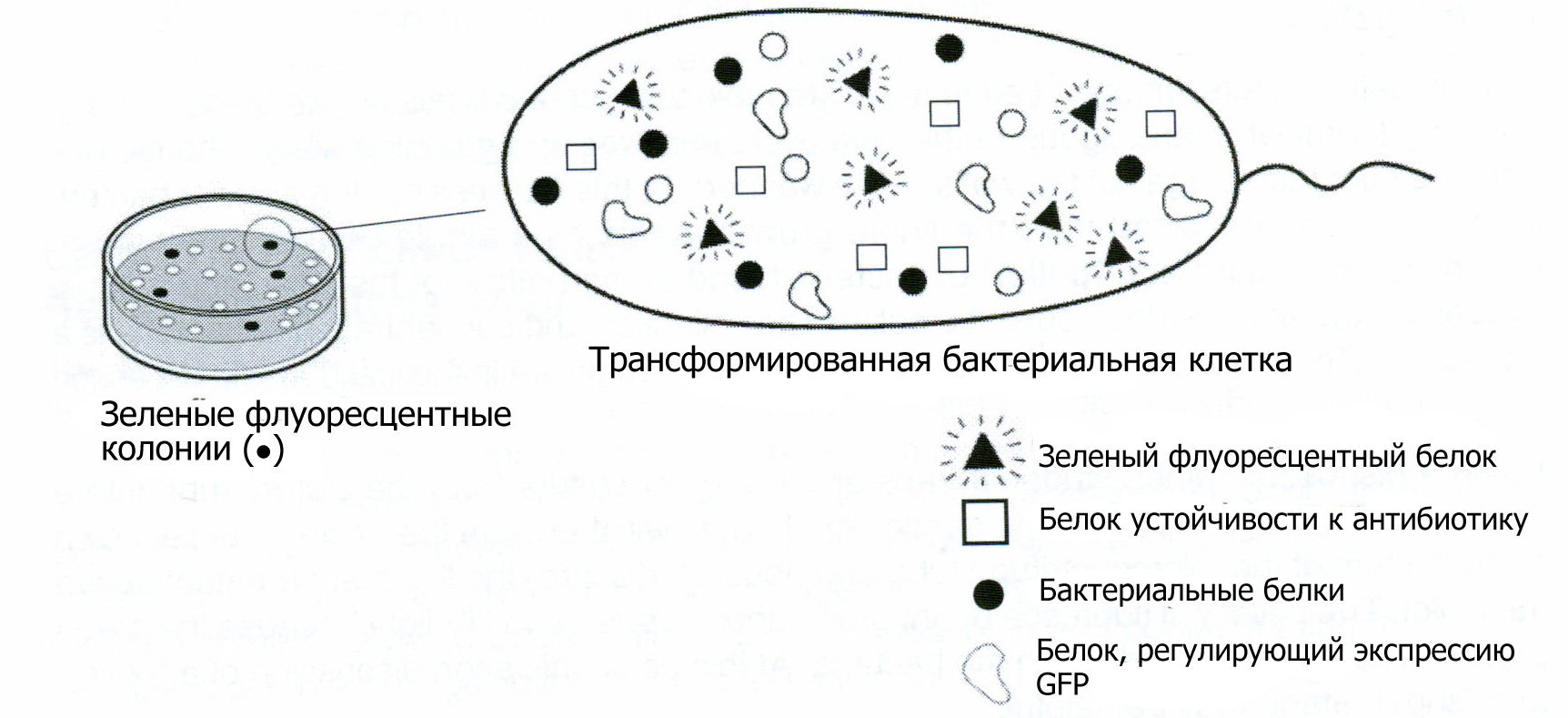
Одна из самых важных концепций работы по трансформации бактерий это концепция регуляции работы генов. Экспрессия зеленого флуоресцентного белка находится под контролем арабинозного промотора. Таким образом, когда бактерии высевались на среду, содержащую арабинозу (LB/amp/ara) экспрессировался GFP и колонии выглядели ярко-зелеными. Напротив, когда бактерии высевались на среду без арабинозы (LB/amp) ген выключался и колонии были белыми (см. Приложение D для дополнительных деталей).
Теперь если взять белую колонию (которая содержит ген GFP, но не экспрессирует его в отсутствие арабинозы) и инокулировать жидкую среду LB/amp/ara, присутствующая в среде арабиноза будет поглощаться клетками и ген GFP заработает. Таким образом, ученики сеют белую колонию со спящим геном GFP в среду ,содержащую арабинозу, она включает ген и культура приобретает способность светиться зеленым. Также ученики сеют зеленую колонию в жидкую среду LB/amp/ara, в этом случае ген остается активным и жидкая культура также будет светиться ярко-зеленым.
Урок 2 Инокуляция и выращивание бактериальной культуры
Выбор одиночных бактериальных колоний
На этом этапе ученики должны выбрать одну белую колонию с чашки LB/amp и одну зеленую колонию с чашки LB/amp/ara для параллельного выращивания в жидких культурах.
Клонирование - это выделение и создание множества копий одного гена. Так как одна бактериальная колония происходит от одной клетки, все бактерии в составе колонии генетически идентичны и называются клонами. Когда ученики выбирают колонии (или клоны) белых и зеленых бактерий с чашки, они выбирают отдельные колонии для переноса в жидкую среду. Отдельные колонии, находящиеся на расстоянии как минимум 1-2 мм от других колоний на чашке, как правило не загрязнены другими бактериями. Схема, приведенная ниже, поясняет экспрессию генов в зеленых колониях.
Преподаватель может сам показать, как выбрать отдельную изолированную колонию и снять ее с агара, используя микробиологическую петлю. Очень важно, чтобы при отборе колоний и посеве в среду использовалась техника стерильной работы. Напоминайте ученикам о необходимости держать чашки и пробирки закрытыми всегда, когда это возможно.
Ночные жидкие культуры
Оптимальная температура для правильного сворачивания и флуоресценции GFP 32º. Если термостата на 32º нет в наличии, культуру можно выращивать при перемешивании при комнатной температуре, но это потребует 48 часов вместо 24.
В этой задаче культуру можно просто инкубировать ночь при 32º для производства белка в достаточном количестве. Тем не менее, интенсивное перемешивание культуры многократно увеличивает аэрацию, позволяя клеткам быстрее расти и производить больше GFP. По этой причине мы настоятельно рекомендуем использовать шейкеры или качалки. Если качалка недоступна, культуру можно встряхнуть вручную в течение 30 секунд и потом инкубировать при 32º 1-2 дня. Просто сильно потрясите пробирку с культурой в течение 30 секунд, как вы трясете баллончик с краской. Затем поместите пробирки, положив их набок, в термостат на 1-2 дня. Горизонтальное расположение максимизирует поверхность среды, находящуюся в контакте с воздухом, что увеличивает диффузию кислорода внутрь клеток. Периодическое встряхивание пробирок во время инкубации еще больше способствует росту клеток. Чем интенсивнее встряхивание, тем лучше рост и тем выше продукция GFP. В любом случае, после инкубации жидкая культура должна светиться ярко-зеленым под ультрафиолетовым светом.
Условия культивирования |
Требуемое время |
32º, на качалке |
1 день |
32º, без перемешивания |
1-2 дня* |
Комнатная температура, на качалке |
2 дня |
Комнатная температура, без перемешивания |
Не рекомендуется |
*Пробирки нужно периодически встряхивать вручную и они должны лежать в термостате горизонтально
Урок 3 Первая стадия очистки: концентрирование и лизис бактерий
Центрифугирование
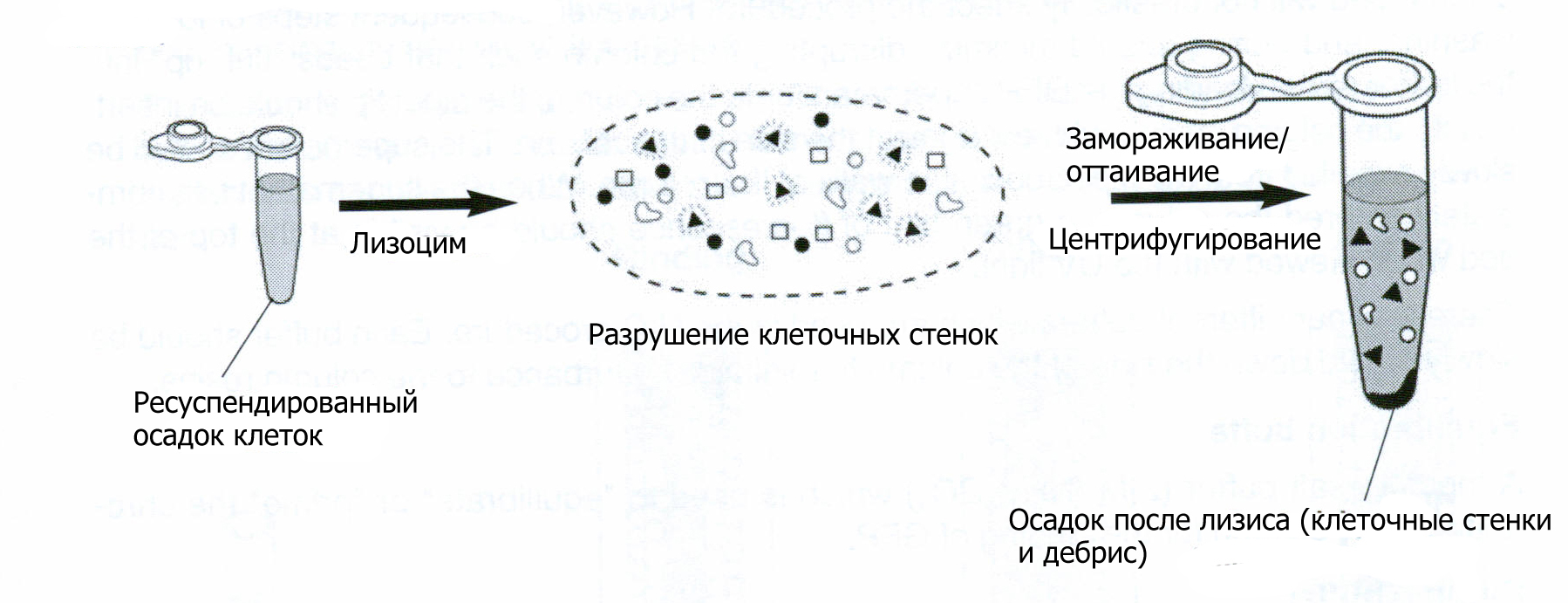
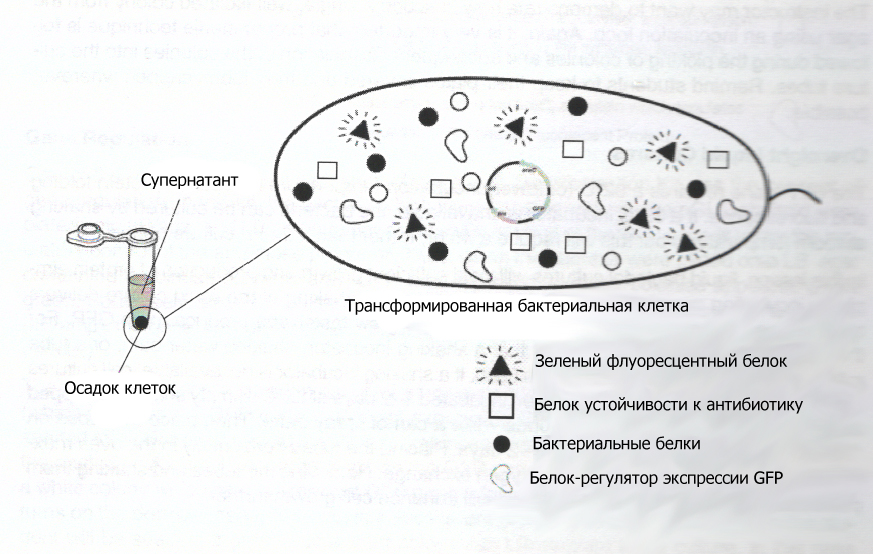
Центрифугирование – это способ разделить молекулы по размеру с помощью очень быстрого вращения (наподобие вращения барабана стиральной машины при отжиме, когда белье прижимается к стенкам). На этом этапе работы с помощью центрифугирования тяжелые бактериальные клетки отделяются от среды. Результатом центрифугирования является «осадок» бактерий на дне пробирки и жидкий «супернатант» над ним. Концентрирование бактерий является первым шагом выделения GFP из выращенной на уроке 2 культуры.
С помощью одноразовой пипетки ученики аккуратно переносят 2 мл культуры из культуральной пробирки в 2 мл микроцентрифужную пробирку. Потом они откручивают пробирки и выливают супернатант. Осадок флуоресцирует зеленым под ультрафиолетовым светом, потому что зеленый флуоресцентный белок находится в бактериальных клетках. На этом этапе это короткое обсуждение «осадка» и «супернатанта» может быть полезным.
Ресуспендирование бактериального осадка
На этом шаге важно проследить, чтобы осадок клеток бактерий был полностью разболтан (ресуспендирован) в буфере ТЕ, с образованием гомогенной жидкости.
Ученики должны добавить 250 мкл буфера к бактериальному осадку, и затем ресуспендировать его, набирая и сбрасывая жидкость в пипетке (если у вас есть вортексы, можно ресуспендировать осадки на вортексе). Нужно продолжать перемешивание до тех пор, пока в суспензии не останется комочков слипшихся бактерий.
Лизоцим
Лизоцим это фермент, разрушающий (лизирующий) клеточные стенки бактерий. Он расщепляет химические связи между остатками сахаров, из которых сделана клеточная стенка. Последующее замораживание-оттаивание помогает полностью разрушить стенку и внутреннюю мембрану клетки. После полного разрушения клетки, или лизиса, ее компоненты, включая GFP, высвобождаются в раствор. Лизоцим есть и в наших слёзах, он действует как антибактериальный агент, предохраняющий глаз от инфекций. Слово «лизоцим» происходит от слова «лизис».
Урок 4 Вторая стадия очистки: удаление бактериального дебриса
Это последнее центрифугирование нужно для того, чтобы отделить крупные части разрушенных клеток, так называемый дебрис (куски клеточной стенки и мембраны, хромосомная ДНК) от мелких растворимых белков, включая GFP. Дебрис осаждается на дне пробирки, тогда как маленькие белки остаются в супернатанте. На этой стадии супернатант будет светиться зеленым под ультрафиолетом. Ученики должны очень аккуратно отобрать супернатант чистой 1 мл пипеткой и перенести его в чистую 2 мл пробирку. Это должно быть сделано сразу же после центрифугирования, чтобы осадок не начал взмучиваться. Остатки дебриса могут забить хроматографическую колонку на следующей стадии, поэтому важно не допустить их попадания в отбираемую жидкость.