
- •Ответы на вопросы по курсу «биохимия» для студентов II курса бакалавриата
- •Методы определения первичной структуры белков.
- •Методы определения пространственной структуры белка.
- •Классификация и номенклатура ферментов.
- •Влияние ингибиторов на активность ферментов.
- •Жирорастворимые витамины.
- •Метаболизм холестерола.
- •Биосинтез пуриновых нуклеотидов.
- •Биосинтез пиримидиновых нуклеотидов.
- •Доказательства генетической роли днк.
- •Посттранскрипционная регуляция генной экспрессии.
- •Особенности структуры тРнк как адапторной молекулы.
- •Механизм действия стероидных гормонов.
Ответы на вопросы по курсу «биохимия» для студентов II курса бакалавриата
(с) Давыдова А. Я.
2012 г.
Предмет биохимии. Место биохимии в системе наук о жизни. Иерархия структурно-функциональной организации живых систем.
Биохимия — наука о химической структуре молекулярных компонентов живых организмов и процессах, лежащих в основе биологических функций и процессов жизнедеятельности. Это наука о молекулярных основах жизни. Термин БИОХИМИЯ был предложен Карлом Ньюбергом в 1902 году, употреблялся в Журнале о Биологической химии с 1905 г и в Основах Физиологии:Биофизика и Биохимия в двух частях.
Особенностями живых организмов («молекулярной логикой живого») являются:
Химическая сложность и высокая степень организации; каждый компонент живого организма имеет специфическую функцию
Живые организмы извлекают, трансформируют и используют энергию окружающей их среды (либо в форме орагнических питательных веществ, либо в виде энергии солнечного излучения)
Живые организмы способны к точному самовоспроизведению и самосборке
Большинство молекулярных компонентов живых систем состоят из атомов углерода, ковалентно связанных с другими атомами углерода, а также водорода, кислорода и азота – это органические соединения. Атом угелрода имеет 6 электронов в оболочке, атом водорода — 1. Атомы углерода в sp3 гибридизации образуют тетраэдр; возможно вращение вокруг одинарных связей — двойная связь короче и исключает свободное вращение. Углерод образует кратные или одинарные связи (по числу отданных на связь электронов) с атомами азота, водорода, фосфора, кислорода, другими углеродами, серой — образуются различные функциональные группы.
Вещества подразделяются на моно-, олиго — (2-5), полимеры; почти все природные полимеры являются гетерополимерами. Макромолекулы состоят из небольшого числа компонентов — белки из аминокислот, НК из нуклеотидов и т.д.
Место биохимии среди естественных наук:
Главной задачей биохимии является установление связи между молекулярной структурой и биологической функцией химических компонентов живых организмов. До создания биохимии вопросы, рассматриваемые ей, входили в органическую химию и физиологию, позднее затронули и медицину (алхимия, открытия Парацельса, теория о «соках» живого, далее — ряд выделения различных веществ из организмов, крах витализма и лабораторный синтез мочевины, выяснение строения различных молекул, развитие современной биохимии-XX век).
В наше время многие считают, что термины «биохимия» и «молекулярная биология» - синонимы. Появились и отдельные ветви биохимии - «медицинская биохимия», «молекулярная медицина» и т. д. Наиболее важные направления исследований в биохимии — генетическая инженерия и биотехнология (создание препаратов и выделение антител, разработка методик лечения, работы по дифференцировке клеток из стволовых, механизм функционирования генома и др. направления)
Иерархия структурно-функциональной организации живых систем:
Уровень 1 — мономеры (нуклеотиды, аминокислоты, сахара)
Уровень 2 — макромолекулы (НК, протеины, целлюлоза)
Уровень 3 — надмолекулярные комплексы (хромосомы, плазмалемма, клеточная стенка)
Уровень 4 — клетка с органеллами.
Другой вариант организации — объединение клеток в ткани (клеточные пласты), а тканей — в органы.
Структура аминокислот. Протеиногенные аминокислоты. Классификация аминокислот по характеру радикала у -углеродного атома.
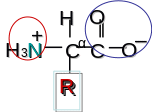
Протеиногенными называются аминокислоты, из остатков которых построены молекулы протеинов (белков). Вообще, существует более 700 аминокислот с различными функциями (например, ГАМК — медиатор, бета-аланин — структурный компонент кофермента А), но далеко не все из них протеиногенные.
Канонических протеиногенных аминокислот 20 (+2) (список выучить отдельно)
По полярности радикала у альфа-углеродного атома аминокислоты классифицируются на:
неполярные (ala, val, leu, ile, met, pro, phe, trp (W) )
полярные (gly, asn (N), gln (Q), ser, thr, tyr (Y), cys)
полярные заряженные отрицательно (asp (D), glu(E))
полярные заряженные положительно (lys (K), arg (R), his)
По ароматичности радикала у альфа-углеродного атома аминокислоты классифицируются на:
АК с алифатической боковой цепью (gly, ala, val, ile, leu)
ароматические АК (phe, tyr. Trp)
АК с линейной кислородсодержащей цепью (ser, thr)
АК с линейной серосодержащей цепью (met, cys)
кислые АК + их производные (asn, gln, asp, glu)
АК с основной боковой цепью (lys, arg, his)
иминокислота (пролин)
АК №21 — селеноцистеин.
Основные характеристики АК — обозначения (одна или три буквы), молекулярный вес и полярность радикала при рН 6-7.
Физико-химические свойства аминокислот: химические свойства функциональных групп аминокислот; кислотно-основные свойства аминокислот.
Все встречающиеся в природе аминокислоты амфотерны (каждая содержит как минимум одну основную и одну кислотную группы).
Группа -СООН — карбоксильная — обусловливает кислотные свойства, обеспечивает реакции этерификации со спиртами, реакции с металлами и основаниями, образование хлорангидридов при реакции с SOCl2 и PCl3/PCl5. В щелочной среде -СООН превращается в анион -СОО(-), который стабилизирован резонансом. Наибольшая электронная плостность — на атоме =О (именно он первым атакуется при гидролизе сложных эфиров, амидов и т.д.)
Группа -NH2 — амино — обуславливает основные (акцепторные) свойства, обеспечивает реакции алкилирования, ацилирования, образование солей аммония, образование диазосоеднинений и из них — спиртов (реакция с HNO2 при 0*С). В кислой среде превращается в -NH3+, при реакции с галогенводородами, галогеналканами и т.д.— в -NH4+Hal-.
Кислотно-основные свойства АК определяют многие физ-хим и биологические свойства белков. На них кроме этого основаны еще и методы выделения и идентификации АК. АК легко растворимы в воде. Кристаллизуются из растворов в форме цвиттерионов, а не в виде недиссоциированных молекул. Все АК при физиологических значениях рН имеют структуру цвиттериона. При растворении в воде кристаллическая АК может отдавать протон (цвиттерион приобретает группу NH2 вместо NH3+) или принимать его (COOH вместо COO-).
pH=pKa+lg([A(-)]/[HA])
Если радикалы АК нейтральные, они почти не оказывают влияния на диссоциацию групп СООН или NH2 группы и величины рК(дисс.)=const. Поэтому кривые титрования практически всех нейтральных АК можно рассматривать на примере аланина. При низком рН почти все его молекулы протонированы и несут + заряд, изоэлектрическая точка pI (при данном рН суммарный электрический заряд молекулы равен 0 и она не перемещается ни к аноду, ни к катоду; при данном рН равновесные концентрации СОО- и NH3+ равны) располагается при рН=6,02, выше этого значения молекулы аланина несут - заряд. pI=(pK(COOH)+pK(NH2))/2.
PI других АК, содержащих дополнительные кислотные или основные группы, зависит и от кислотности/основности радикалов этих АК. Для лизина, например, pI вычисляется из полусуммы значений pK для альфа и эпсилон-NH2 групп.
Таким образом, в интервале рН от 4,0 до 9,0 почти все АК существуют преимущественно в форме цвиттерионов с группами NH3+ и COO-. При физиологических значениях рН тканей и крови АК не обладают измеримой буферной емкостью, эту способность они приобретают только при значениях рН близких к их рК (рН 1,7-3,2 и 8,6-10,8).
Еще одно свойство присуще ароматическим АК. Помимо перечисленного, они поглощают свет УФ области спектра.
Физико-химические свойства аминокислот: кислотно-основные свойства аминокислот, оптические свойства аминокислот.
Кислотно-основные свойства — см. выше
Оптические свойства АК:будучи растворенными в воде, АК способны вращать плоскость поляризованного луча (кроме глицина). Это свойство связано с наличием почти у всех природных АК в альфа-положении асимметричного атома углерода. Величина удельного вращения для большинства АК — 10-30*.
Примерно половина АК правовращающие (+) - ala, ile, glu, lys и т. д., а другая — левовращающая (-) - phe, trp, leu и т. д. Все природные АК (из гидролизированных белков) — из L-ряда, а величина и знак вращения зависят от природы радикалов и значения рН раствора.
Оценка L/D конфигурации АК осуществляется сравнением с глицериновым альдегидом. + и — вращение не совпадает с D/L номенклатурой! L-номенклатура АК обеспечивает выполнение правила CO-R-N при изображении АК в клиновидной проекции.
Типы проекций для ихображения энантиомеров — Полная Фишера (клиновидная), краткая Фишера, структурная.
Возможно наличие в молекуле нескольких хиральных центров (например, у треонина). Тогда появляются еще и «неполные отражения» - диастереомеры (L и D аллотреонины). D-АК не обнаружены в белках, но распространены в природе.
Самые распространенные АК в белках — дикарбоновые кислоты, leu и lys.
Принципы структурной организации белков. Основные функции белков. Иерархия структурно-функциональной организации живых систем.
Белки, или протеины (proteos — первейший, важнейший) — высокомолекулярные азотсодержащие органические соединения, молекулы которых построены из остатков АК.
Полипептидная теория строения белков была сформулирована Фишером в 1902 году. Согласно этой теории, белки-сложные полипептиды, в которых отдельные АК связаны друг с другом пептидными связями -CO-NH-, возникающими при взаимодействии групп СООН и альфа-NH2. Так возникают ди, трипептиды и т. д. Наименование пептидов осуществляется с первой N-концевой АК до названия последней C-концевой.
Доказательства этой теории:
в природных белках сравнительно мало титруемых свободных COOH и NH2 групп
при гидролизе белков образуются стехиометрические количества COOH и NH2 групп
белки расщепляются протеазами на пептиды с концевыми АК, соответствующими избирательности протеиназ.
Биуретовую реакцию дает и биурет, содержащий пептидную связь, и белки
полипептидную структуру белков подтверждает анализ рентгенограмм их кристаллов
можно синтезировать чисто химически пептиды с уже известным строением
Кроме пептидной связи, в белках есть ковалентные (S-S между SH группами цистеина и др.) связи и нековалентные (водородные и т. д.)
Особенности строения полипептидной цепи:
своеобразие расположения атомов С и N, находящихся примерно в одной плоскости, и атомов Н и радикалов, направленных к этой плоскости под углом примерно 109*
своеобразие пептидной связи: расстояние C-N промежуточное между одинарной и двойной — возможно образование енольной (лактимной) формы. Пептидная связь стабилизирована резонансом:кислород тянет на себя двойную связь, а азот подает пару в систему сопряжения — O = C — N** - H ↔ O(-) - C = N - H
своеобразие радикалов, несущих свободные группы NH2, COOH, OH, SH, создание катионных и анионных центров в молекуле
По доказанной теории Линдерстрема-Ланга, в структурной организации белковой молекулы имеются 4 уровня — первичная, вторичная, третичная и четвертичная структуры.
Функциями белков являются:
каталитическая — большинство ферментов являются белками
транспортная — гемоглобин (перенос газов), альбумин (перенос липидов), белки сыворотки
защитная — выработка белковых антител, способность белков плазмы(фибриноген) к свертыванию
сократительная — актин+миозин, белки расхождения хромосом в митозе
структурная — коллаген, фибриллярные белки, комплексы с углеводами:муцин и т. д.; в комплексе с phL белки образуют мембраны клеток
гормональная — гормоны гипофиза, поджелудочные гормоны
питательная (резервная) для плода — белки яйца (овальбумины), молока (казеин)
экспрессия генетической информации
генерирование и передача нервных импульсов
способность поддерживать онкотическое давление в клетках и крови
буферные свойства — поддержание рН внутренней среды и т. д.
Про иерархию было выше.
Пептиды – полимеры аминокислот. Пептидная связь, ее характеристика. Первичная структура белков.
Про пептиды и пептидную связь см. выше.
Первичная структура белков: под ней подразумевают порядок, последовательность расположения аминокислотных остатков в полипептидной цепи. Первичная структура белков уникальна и детерминирована генетически. Зная первичную структуру, можно точно написать структурную формулу молекулы, если она представлена одной полипептидной цепью.
Стабильность первичной структуры обеспечивается главновалентными пептидными связями и небольшим числом S-S связей. В цепи могут быть обнаружены разнообразные комбинации АК; повторяющиеся последовательности АК редки.
В некоторых ферментах встречаются идентичные пептидные структуры, содержащие неизменные участки и вариабельные последовательности АК (особенно в областях активных центров).
В первичной структуре цепи детерминированы II, III и IV структуры, определяющие пространственную конформацию молекулы.
Выделяют углы внутреннего вращения:
омега — по пептидной связи CO-NH
фи — между C(альфа) и NH
пси — между С(альфа) и СО
На их основе строятся конформационные карты в зависимости от того, какие конформации а.к.о. в молекуле разрешены (карты Рамачандрана).
