
- •Шкала электромагнитных волн. Классификация частотных интервалов, принятая в медицине
- •Действие электрического поля на организм Поляризация диэлектриков в электрическом поле
- •Электрические явления на границе между твердым телом и жидкостью
- •Электрокинетические явления
- •Электрофорез
- •Двойной электрический слой Поляризация в растворах электролитов
- •Постоянный ток в биологических объектах
- •Физиологическое действие постоянного тока
- •Переменный ток в биологических объектах
- •Медицинское применение постоянного тока
- •Импульсная электротерапия
- •Вопросы электробезопасности медицинской аппаратуры
- •Поражение электрическим током
- •Биологическое действие постоянного магнитного поля
- •Магнитные поля в природе и в медицине
- •Взаимодействие переменного электромагнитного поля с веществом
- •Живой организм в электромагнитном поле
- •Физические основы электротерапии и электрохирургии
- •Электротерапия
- •Электрохирургия
- •Оптические излучения в биологии
- •Ф изические явления при поглощении света
- •Фотохимические реакции
- •Люминесценция
- •Люминесцентный анализ
- •Биолюминесценция
- •Биологическое действие света
- •Биологическое действие ик излучения
- •Видимый свет Биофизика зрительного восприятия
- •Физические свойства лазерного излучения
- •Биологическое действие лазерного излучения
- •Лазеры в медицине
- •Тб при работе с лазерами
- •Биоакустика. Физические основы акустики
- •Источники и приемники звука
- •Эффект Доплера
- •Звук как психофизическое явление
- •Слуховой аппарат человека
- •Биологическое действие звука
- •Инфразвук
- •Ультразвук
- •Ультразвук в медицине
- •Ультразвуковая терапия
- •Ультразвуковая хирургия
- •Ультразвуковая диагностика
Электрические явления на границе между твердым телом и жидкостью
На границе между твердым телом и жидкостью происходит пространственное распределение электрических зарядов, приводящее к возникновению разности потенциалов между соприкасающимися веществами. Наибольшее значение имеют явления, возникающие на поверхности твердых тел, погруженных в растворы электролитов. Пусть металл погружен в водный раствор своей собственной соли ZnSO4. Ионы SO4, находящиеся в растворе, вступают в химическую реакцию с ионами цинка, находящимися на поверхности кристаллической решетки металла, образуя ZnSO4, который, растворяясь в воде, вновь диссоциирует на ионы цинка и кислотного остатка. Таким образом, ионы цинка непрерывно переходят в раствор, который заряжается положительно, а металл заряжается отрицательно. Одновременно происходит и обратный процесс: находящиеся в растворе беспорядочно движущиеся ионы цинка встречают цинковый электрод и осаждаются на нем, что приводит к уменьшению положительного заряда раствора. Если концентрация ионов цинка в растворе достаточно велика, то поток ионов из раствора в металл станет больше потока ионов из металла в раствор и металл зарядится положительно. Очевидно, что для каждого металла в растворе его соли существует такая концентрация раствора [с]о, при которой ни металл, ни раствор не приобретают электрических зарядов. Величину [с]0 называют концентрацией нулевого заряда.
Чем больше положительный заряд раствора, тем больше кулоновская сила, препятствующая выходу новых положительных ионов из металла в раствор. В конечном счете между металлом и раствором устанавливается динамическое равновесие, при котором число ионов, выходящих в раствор, равно числу ионов, возвращающихся обратно в металл, и между металлом и раствором устанавливается определенная разность потенциалов. Потенциал металла относительно раствора называют электродным потенциалом.
Величина электродного потенциала зависит от рода металла, от концентрации его ионов в растворе, от температуры и природы растворителя, и ее можно получить из следующих соображений. Представим себе сосуд, две половины которого разделены полупроницаемой мембраной, пропускающей ионы металла с валентностью z. Пусть в одной половине сосуда находится раствор соли этого металла с концентрацией [с], а в другой половине – такой же раствор, но с концентрацией нулевого заряда [с]0 - В результате диффузии ионов через мембрану между растворами установится мембранная разность потенциалов Ем. Но как ясно из сказанного выше, раствор с концентрацией нулевого заряда создает такой же поток ионов, как и металлический электрод. Уподобив поверхность металла полупроницаемой мембране, мы можем вычислить величину электродного потенциала металла Еэд, считая его равным Ем :
![]()
В
этом равенстве концентрации [с]
и [с]0
можно выражать в любых, но одинаковых
единицах. Обычно принято использовать
молярные концентрации (моль/л). Если
раствор обладает нормальной концентрацией
(с = 1
моль/л), то ln[с] = 0
и Еэд = –![]() .
Эта
величина зависит при данной температуре
только от природы металла и представляет
собой абсолютный
нормальный электродный потенциал.
Обозначив
его через Еан,
получим
.
Эта
величина зависит при данной температуре
только от природы металла и представляет
собой абсолютный
нормальный электродный потенциал.
Обозначив
его через Еан,
получим
![]()
Это выражение носит название уравнения Нернста.
Измерить непосредственно величину Еан невозможно, так как для этого надо было бы один провод от вольтметра подсоединить к металлу, а другой погрузить в раствор, где он сам приобрел бы определенный электродный потенциал. Таким образом, мы измерили бы не электродный потенциал исследуемого металла, а разность потенциалов между ним и проводом. Поэтому условились применять в качестве второго электрода водородный электрод, состоящий из пластины, насыщенной водородом, и находящийся в растворе, содержащем ионы водорода (например, в растворе кислоты) с определенной концентрацией. Электродный потенциал металла в водном растворе его соли с нормальной концентрацией ионов, измеренный относительно водородного электрода, называют нормальным электродным потенциалом Ен. Значения нормальных электродных потенциалов некоторых элементов приведены в таблице. Таблица эта представляет известный ряд напряжений, причем каждый элемент, стоящий левее, вытесняет из раствора элемент, стоящий правее.
Нормальные электродные потенциалы некоторых металлов при 25°С
Элемент К+ AI3+ Zn2+ Fe2+ Нг Cu2+ Hg2+ Ag+ Pt+ Au+ Ен, В –2,92 –1,66 –0,763 –0,441 0,00 0,34 0,79 0,80 1,20 1,70 |
Электродный потенциал металла относительно водородного электрода вычисляется также по уравнению Нернста
![]()
Следует, однако, помнить, что так же, как при вычислении мембранных потенциалов, в случае концентрированных растворов в уравнение Нернста вместо концентрации необходимо подставлять значение активности ионов в данном растворе.
Поскольку при выходе ионов металла в раствор сам металл заряжается отрицательно, то вследствие кулоновского притяжения избыточные ионы металла в растворе сосредоточиваются в тонком слое у поверхности металла, образуя двойной электрический слой (рис. а). Такие двойные слои возникают не только на границе раздела металл – жидкость, но и на границе раздела между любым твердым телом и жидкостью или двумя несмешивающимися жидкостями. Природа двойного слоя, помимо указанной, может быть обусловлена адсорбцией на поверхности ионов одного знака или ориентацией полярных молекул (например, молекул растворителя), в результате чего все молекулы оказываются обращенными одним и тем же концом к поверхности раздела (рис. 49,6). Адсорбироваться могут как катионы, так и анионы, но чаще адсорбируются анионы, так как они имеют меньших размеров гидратную оболочку.
И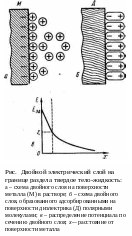 оны
раствора, образующие внешнюю часть
двойного электрического слоя, притягиваются
к его внутренней части, находящейся
внутри твердого тела. Силы притяжения
убывают с расстоянием, и чем дальше от
поверхности, тем менее эти силы могут
противодействовать тепловому движению.
Поэтому двойной слой имеет сложную
структуру. У самой поверхности образуется
его плотная часть толщиной d,
примерно
равной диаметру иона (слой
Гельмгольца, который
впервые ввел представление о двойном
электрическом слое), и менее плотная,
диффузная часть (слой
Гуи). В
этой части слоя плотность ионов убывает
вследствие их диффузии в объем жидкости
(см. рис.). Эффективная толщина двойного
слоя имеет величину порядка нескольких
ионных диаметров (0,1–0,5 нм). При движении
частицы основная часть двойного слоя
перемещается вместе с ней. Двойной
электрический слой представляет собой
своеобразный конденсатор. Поскольку
расстояние между положительной и
отрицательной обкладками его очень
мало, то емкость конденсатора весьма
значительна, достигая нескольких
десятков мкФ на 1 см2,
и внутри него действует большая
напряженность поля (десятки МВ/м).
Разность потенциалов между адсорбционным
слоем, который может перемещаться вместе
с частицей и окружающей средой, носит
название электрокинетического, или
-потенциала
(дзета-потенциала). Величина дзета-потенциала
зависит от средней объемной плотности
заряда в двойном слое, от его толщины и
диэлектрической проницаемости среды,
разделяющей поверхности слоя. Что
касается знака дзета-потенциала, то он
определяется соотношением между
величинами диэлектрической проницаемости
частицы и жидкости. Обычно из двух
соприкасающихся тел положительным
будет то, которое имеет большую
диэлектрическую проницаемость. Например,
стекло (
= 5) в воде (
= 81) имеет отрицательный дзета-потенциал,
а в эфире (
= 4,3) приобретает положительный
дзета-потенциал. Для частиц кварца,
капель масла и пузырьков воздуха в воде
дзета-потенциал имеет величину от 30 до
60 мВ.
оны
раствора, образующие внешнюю часть
двойного электрического слоя, притягиваются
к его внутренней части, находящейся
внутри твердого тела. Силы притяжения
убывают с расстоянием, и чем дальше от
поверхности, тем менее эти силы могут
противодействовать тепловому движению.
Поэтому двойной слой имеет сложную
структуру. У самой поверхности образуется
его плотная часть толщиной d,
примерно
равной диаметру иона (слой
Гельмгольца, который
впервые ввел представление о двойном
электрическом слое), и менее плотная,
диффузная часть (слой
Гуи). В
этой части слоя плотность ионов убывает
вследствие их диффузии в объем жидкости
(см. рис.). Эффективная толщина двойного
слоя имеет величину порядка нескольких
ионных диаметров (0,1–0,5 нм). При движении
частицы основная часть двойного слоя
перемещается вместе с ней. Двойной
электрический слой представляет собой
своеобразный конденсатор. Поскольку
расстояние между положительной и
отрицательной обкладками его очень
мало, то емкость конденсатора весьма
значительна, достигая нескольких
десятков мкФ на 1 см2,
и внутри него действует большая
напряженность поля (десятки МВ/м).
Разность потенциалов между адсорбционным
слоем, который может перемещаться вместе
с частицей и окружающей средой, носит
название электрокинетического, или
-потенциала
(дзета-потенциала). Величина дзета-потенциала
зависит от средней объемной плотности
заряда в двойном слое, от его толщины и
диэлектрической проницаемости среды,
разделяющей поверхности слоя. Что
касается знака дзета-потенциала, то он
определяется соотношением между
величинами диэлектрической проницаемости
частицы и жидкости. Обычно из двух
соприкасающихся тел положительным
будет то, которое имеет большую
диэлектрическую проницаемость. Например,
стекло (
= 5) в воде (
= 81) имеет отрицательный дзета-потенциал,
а в эфире (
= 4,3) приобретает положительный
дзета-потенциал. Для частиц кварца,
капель масла и пузырьков воздуха в воде
дзета-потенциал имеет величину от 30 до
60 мВ.
Строение двойного электрического слоя оказывает очень большое влияние на электрохимические явления на поверхности раздела двух веществ, в частности на поверхности клеточных мембран. Поэтому в биофизике разработаны специальные методы для измерения электроемкости двойного слоя, дзета-потенциала и других его характеристик.
