
- •Теоретические основы клинической диагностики
- •Понятие о симптомах болезни
- •Понятие о диагнозе заболевания
- •Прогноз или диагноз течения и исхода болезни
- •История болезни
- •Общая диагностика
- •Регистрация животного
- •Данные о наследственности
- •Обхождение с животными при исследовании
- •1) Голову делят на лицевую и черепную части.
- •Выстукивание, перкуссия
- •Измерение температуры тела
- •Специальные методы исследования
- •Определение темперамента
- •Типы высшей нервной деятельности
- •Типы конституции
- •Клиническое значение типов конституции
- •У лошади.
- •Исследование кожи
- •Физиологические и патологические свойства кожи
- •Симптоматология первичных заболеваний кожи
- •Исследование лимфатических узлов и сосудов
- •Анатомо-физиологические данные
- •Осмотр и пальпация области сердца
- •Сердечный толчок
- •Перкуссия сердца
- •Аускультация сердца
- •Экстракардиальные шумы
- •Нарушение ритма сердечной деятельности
- •Графические методы исследования
- •Экстракардиальные нарушения ритма
- •Интракардиальные нарушения ритма
- •Исследование пульса
- •Качественные изменения пульса патологического характера
- •Исследование вен
- •Важнейшие симптомы при заболевании сердечно-сосудистой системы
- •4. Синдром поражения перикарда. Для сухого перикардита характерны шум трения перикарда и болевая реакция на давление в области сердца. Шумы синхронны с деятельностью сердца.
- •Исследование органов дыхания
- •Анатомо-физиологические данные
- •Исследование верхнего отрезка дыхательных путей
- •Исследование придаточных полостей носа
- •Кашель и его клиническое значение
- •Осмотр грудной клетки
- •Пальпация грудной клетки
- •Перкуссия грудной клетки
- •Аускультация грудной клетки
- •Основные шумы дыхания
- •Придаточные шумы дыхания
- •Пробный прокол грудной клетки
- •Пневмография
- •Определение функциональной способности легких
- •Важнейшие симптомы при заболевании аппарата дыхания
- •1. Синдром воспалительной инфильтрации слизистой оболочки носа.
- •Исследование органов пищеварения
- •Физиологическая функция аппарата пищеварения
- •Исследование приема корма и воды
- •Исследование верхнего отрезка пищеварительного аппарата
- •Исследование зоба у птиц
- •Исследование преджелудков у жвачных
- •Исследование желудка у лошади
- •Исследование желудочного содержимого у лошади
- •Исследование желудка мелких животных
- •Исследование кишечника
- •Исследование кишечника жвачных животных
- •Исследование кишечника у лошади
- •Исследование кишечника у мелких животных
- •Дефекация и ее расстройства
- •Исследование фекалий
- •Исследование транссудатов и экссудатов
- •Важнейшие симптомы при заболевании органов пищеварения
- •2. Синдром поражения глотки. Кардинальными симптомами являются затрудненное глотание, пустые глотательные движения, болезненность и при- пухание области глотки.
- •Исследование печени
- •Патология мочеотделения
- •Методика исследования почек
- •Определение функциональной способности почек
- •Исследование мочевых путей
- •Исследование мочи
- •Физические свойства мочи
- •Химическое исследование мочи
- •Определение углеводов
- •Организованные осадки в моче
- •Неорганизованные осадки в моче
- •Важнейшие симптомы при заболеваниях мочевых органов
- •Половые органы самок
- •Важнейшие симптомы поражения половых органов
- •Исследование нервной системы
- •Общая характеристика нервной системы
- •Нервная система птиц
- •Расстройства поведения животных
- •Непроизвольные движения и вынужденные положения
- •Исследование черепа и позвоночника
- •Исследование органов чувств (анализаторов)
- •Исследование кожной и глубокой чувствительности
- •Исследование двигательной сферы
- •Движение и его расстройство
- •4. Походка (произвольные движения). Для изучения произвольных движений необходимо внимательно наблюдать за движениями животного как с
- •Рефлексы и их расстройства
- •Вегетативная (висцеральная) нервная система
- •-Рабочие органы-
- •Методика исследования
- •Зоны кожной чувствительности
- •Нервная трофика нервные дистрофии
- •Спинномозговая жидкость и ее диагностическое значение
- •Важнейшие симптомы при заболевании нервной системы
- •2. Синдром поражения спинного мозга. При поражении спинного мозга характерны мышечная атрофия, атония, арефлексия, реакция перерождения и диссоциированный тип расстройства чувствительности.
- •Исследование крови
- •Анатомо-физиологические данные
- •Общая характеристика крови
- •Техника получения крови и костного мозга
- •Резистентность эритроцитов у здоровых животных
- •Подсчет форменных элементов крови
- •Техника приготовления мазков
- •Лейкоциты
- •Изменения лейкоцитарной формулы
- •Изменение количества лейкоцитов
- •Патологические изменения протоплазмы и ядра лейкоцитов
- •Учение шиллинга о лейкоцитозе в свете[неврогенной теории
- •Определение лейкоцитарного и гематологического профиля
- •Сетка для гематологического профиля лошади (по Домрачеву)
- •Основы клинического использования картины крови
- •Определение функциональной способности кроветворных органов
- •Важнейшие симптомы заболевания системы крови
- •Исследование селезенки
- •Специфические методы исследования
- •Туберкулинизация
- •Аллергическая диагностика паратуберкулеза
- •Маллеинизация
- •Аллергическая диагностика бруцеллеза
- •Ветеринарная диспансеризация
- •3. Изучение внешней среды, окружающей животных: а) изучение истории развития хозяйства и животноводства, в частности;
- •Общая часть
- •Специальная часть
Определение углеводов
У домашних животных в моче встречаются виноградный сахар, лактоза, пентоза и редко—галактоза. Виноградный сахар в незначительном количестве находится в крови и представляет ее нормальную составную часть. В моче здоровых животных виноградный сахар встречается в ничтожно малых количествах, а потому практически моча животных считается свободной от глюкозы. Появление глюкозы в моче в значительных количествах обусловливается увеличением ее в крови, с гипергликемией, что связывается с нарушением углеводного обмена. В отдельных случаях появление повышенного количества углеводов в моче может быть при нормальном количестве сахара в крови. В этих случаях в основе появления углеводов в моче лежит нарушение почечного фильтра и проходимости его для углеводов.
Глюкозурия является постоянным признаком сахарного диабета лошадей и собак, почему и называется симптоматической. Кроме того, глюкозурия является надежным признаком бешенства травоядных. У плотоядных при бешенстве углеводы в моче имеются в незначительном количестве, а при паралитической форме бешенства отсутствуют совсем. Менее значительная глюкозурия отмечается при чуме собак, органических и функциональных заболеваниях нервной системы, болезнях печени и родильном парезе крупного рогатого скота.
Молочный сахар является постоянной составной частью мочи у стельных коров. Лактозурия исчезает обычно к концу 2—3-й недели после отела. Реже юна держится несколько дольше, до середины лактации и даже до конца ее. У молодых животных лактозурия отмечается при недостаточном усвоении лактозы организмом. При задержках молока лактозурия может быть очень значительной. Из патологических процессов, сопровождающихся лакто-зурией, можно назвать родильный парез, воспаление вымени, закупорку сосков.
Пентозы, появляясь в моче травоядных в повышенном количестве, обусловливают развитие пентозурии. Это может быть при обильном кормлении
животных.
Моча, содержащая углеводы, изменяет свои физические свойства. Удельный вес ее повышается, реакция становится кислой, моча вначале бывает прозрачной, лишенной окраски и без осадка. При стоянии, вследствие развития микроорганизмов, моча мутнеет и выделяет пузырьки угольной кислоты.
Углеводы представляют собой альдегидные и кетонные производные многоатомных спиртов. Вследствие наличия альдегидных и кетонных групп они обладают редуцирующей способностью. Этой способностью обладают также мочевая кислота, креатинин, красящие вещества мочи и соединения глюкуро-новой кислоты. Вот почему пробы, основанные на редуцирующей способности, не вполне доказательны. Никогда не следует ограничиваться одной какой-нибудь пробой, а, когда получается положительный результат на глюкозу, следует ставить и более надежную пробу на брожение.
Пробы на углеводы должны производиться с мочой, свободной от белка. Для этого ставится проба с кипячением, после чего белок, если он окажется, удаляют фильтрованием. Если моча очень концентрирована, то ее нужно разводить пополам водой.
Проба Троммера. Эта проба основана на восстановлении глюкозой щелочного раствора окиси меди в закись или гидрат закиси меди. К 3 мл мочи приливают 1 мл 10%-ного раствора едкого кали или натра и затем по каплям прибавляют 10%-ный раствор сернокислой окиси меди до появления следов нерастворяющегося осадка гидрата окиси меди. Растворение происходит до тех пор, пока в моче имеется свободный сахар, следовательно, чем больше в моче находится сахара, тем больше растворяется в ней гидрата окиси меди. Лазурево-синюю жидкость осторожно подогревают на пламени горелки, но не доводят до кипения. Если есть сахар, то на месте нагрева появляется желтая полоска гидрата закиси или красный осадок закиси меди. Изменение цвета постепенно распространяется на всю жидкость и, наконец, выпадает осадок.
Проба Гейнса. Ввиду того, что проба Троммера является показателем восстановительной способности многих составных веществ мочи, а не исключительно наличия глюкозы, Гейне предложил некоторое видоизменение этой пробы.
Состав реактива: 2,5 медного купороса растворяют при нагревании в 250 мл смеси, приготовленной из равных количеств дистиллированной воды и чистого глицерина. К полученной жидкости прибавляют 100 мл 10%-ного раствора едкого кали и доливают водой до объема в 500 мл.
На 3 мл реактива, нагретого до кипения, по каплям прибавляется испытуемая моча и продолжается кипячение. В присутствии глюкозы появляется желтое или красное окрашивание. Вся жидкость постепенно становится мутной. При стоянии выпадает осадок желтого или красного цвета.
Проба Бенедикта. В качестве реактива используется следующий состав: медного купороса 17,5, лимоннокислого натрия 173,0, углекислого натрия 100,0, дистиллированной воды до 1 л.
К 3 мл реактива Бенедикта добавляют 5—10 капель мочи, взбалтывают и кипятят в течение 2 минут. В присутствии сахара получается зеленый, желтый или красный осадок.
Проба Ниландера. Состав реактива: 4,0 основного азотнокислого висмута смешивают с 4,0 сегнетовой соли и растворяют при умеренном нагревании в 100 мл 10%-ного едкого натрия, после чего раствор фильтруют. Реактив сохраняется в темной посуде.
К 3 мл испытуемой мочи, свободной от белка, прибавляют 1 мл реактива Ниландера и кипятят не менее 3 минут с момента закипания жидкости. Жидкость окрашивается в желтый или желто-бурый цвет. На дне пробирки спустя некоторое время собирается черный осадок.
Мочевая кислота и креатинин не влияют на эту реакцию. Проба эта удобна и может использоваться для клинических целей в сочетании с другими реакциями.
Проба с фенилгидраз.ином по К о-варскому. В результате взаимодействия фенилгидразина с глюкозой образуется глюкозозон.
Рис. 61. Сахарометр
Лас-сар-Кона.
К 5 мл мочи добавляют 5 капель чистого фенилгидразина, 10 капель ледяной уксусной кислоты и около 1 мл насыщенного раствора хлористого натра, после чего смесь нагревают до кипения. После охлаждения выделяется желтый осадок, состоящий из красивых кристаллических игл, собранных в виде звезд или снопов, типичных для глюкозозона. Осадок исследуется под микроскопом. Точка плавления кристаллов, характерных для виноградного сахара, равна 205°.
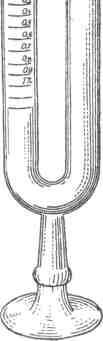
Бродильная проба. Наиболее надежным способом выявления сахара в моче является бродильная проба. Эта проба позволяет не только выявлять глюкозу в моче, но и определять ее количество.
Проба с брожением основана на принципе брожения сахара с дрожжами и распада его на спирт и угольную кислоту (С6Н1206=2С6Н6ОН+2С02). Проводится так, чтобы можно было собрать выделяющуюся С02, образование которой и служит доказательством наличия сахара в моче. Проба производится только с мочой свежей и не содержащей белка. Моча должна быть кислой реакции; при щелочной реакции подкисляется виннокаменной кислотой. Проба производится в особом аппарате Эйнгорна или Лассар-Кона. Оба прибора представляют У-образные стеклянные трубки на подставке. Один конец трубки имеет расширение. На боковой поверхности другого колена имеется шкала, по которой определяется содержание сахара в процентах и объем образовавшейся в результате брожения угольной кислоты.
К 20 мл испытуемой мочи добавляют около 1 г прессованных дрожжей, свободных от крахмала, размешивают стеклянной палочкой и затем наливают в сахарометр. Градуированная часть сахарометра заполняется мочой и не должна содержать ни одного пузырька воздуха. Это достигается переворачиванием прибора. Заряженный сахарометр помещается на сутки в термостат при температуре 30°. При наличии глюкозы в моче, в верхней части аппарата собирается С02. Количество глюкозы и С02 определяется по шкале.
Для контроля ставится еще две параллельные пробы. Одна с дистиллированной водой и дрожжами и вторая с раствором виноградного сахара и дрожжами. Чтобы убедиться в том, что газ в аппарате есть, можно в него впустить едкую щелочь, которая и поглотит всю С02, и аппарат снова наполнится жидкостью.
При малом количестве виноградного сахара может и не образоваться пузырька газа. Для контроля перебродившую мочу снова подвергают исследованию с помощью реакции Ниландера. Если наблюдавшаяся раньше положительная реакция после брожения будет отсутствовать, то можно считать, что сахар в моче имеется.
Определение количества глюкозы по Робертсу. 300 мл испытуемой мочи разделяют на две равные части, после чего к одной половине добавляют растертые дрожжи. Через 24 часа в обеих порциях мочи определяется удельный вес и разница умножается на 0,23. Результат перечисления дает процент глюкозы в данной моче.
Исследование мочи с помощью поляризационного аппарата. Проба с поляризационным аппаратом дает возможность установить разницу между глюкозой и другими редуцирующими веществами, вращающими влево, например с глюкуроновыми кислотами. При незначительных количествах сахара эта проба должна комбинироваться с пробой брожения.
Моча для исследования должна быть совершенно прозрачной, по возможности бесцветной и свободной от белка. Мутная моча просветляется прибавлением нейтрального уксуснокислого свинца, взбалтыванием и фильтрованием через несмоченный фильтр. Трубка аппарата наполняется мочой с таким расчетом, чтобы не оставалось пузырьков воздуха. После этого аппарат ставят на нулевое деление. После вставления трубки, наполненной мочой, в которой имеется глюкоза, правая половина зрительного поля оказывается темной. Вращая винт, добиваются совершенно ровного освещения обеих половин поля зрения. По шкале и нониусу определяется, на какое количество делений нуль нониуса отклонился вправо от нуля шкалы. Эти деления обозначают целые проценты. Количество черточек нониуса вправо от нуля указывает на число десятых долей процента сверх целого числа.
После определения процентного содержания сахара в моче высчитывают, какое количество сахара выводится с мочой за сутки.
Определение ацетоновых тел в моче. Между понижением способности расщепления сахара и появлением в моче ацетоновых тел существует тесная связь. К ацетоновым телам относятся масляная кислота, ацетоуксусная кислота и ацетон. Первым продуктом расщепления оксимасляной кислоты является ацетоуксусная кислота, которая окисляется дальше в ацетон. Ацетоновые тела появляются в моче при недостаточной доставке углеводов, а также при усиленном расщеплении жиров и белков. В моче появляется не сама окси-масляная кислота, а продукты ее расщепления.
По Кизелю, в моче здоровых животных всегда обнаруживаются следы ацетона; так, в моче лошади их находится 0,38—3,86 мг на 1 л, а в моче коровы 0,2—2,4. Количество ацетона резко повышается при ацетонемии крупного рогатого скота, достигая 12,0 на 1 л мочи. При родильном парезе крупного рогатого скота содержание ацетона в крови достигает 69,0 на 100 мл сыворотки. В значительно меньших размерах ацетоновые тела обнаруживаются при атониях преджелудков у коров и при продолжительных расстройствах желудочно-кишечного тракта всех сельскохозяйственных животных. Исключительно важное значение ацетоновые тела имеют при сахарном диабете, где они вследствие кислотного действия оксимасляной и ацетоуксусной кислот обусловливают развитие кислотной интоксикации, с клинической картиной диабетической комы.
Проба Либена на ацетон. 5 мл отгона или профильтрованной мочи подщелачивают раствором едкого натра до яснощелочной реакции, затем прибавляют немного иода (4—6 капель) или люголевского раствора и слабо нагревают. В присутствии ацетона образуется йодоформ, выпадающий в виде желтого кристаллического осадка, издающего характерный запах йодоформа. Проба очень чувствительна.
Проба Легаля на ацетон. К 5 мл профильтрованной мочи или отгона прибавляют 5 капель свежеприготовленного, насыщенного на холоду раствора нитропруссиднатрия и подщелачивают едким натром (1 мл 15%-ного раствора). Моча окрашивается в рубиново-красный цвет, который в присутствии ацетона, после прибавления уксусной кислоты до сильно кислой реакции, переходит в карминово-красное, или пурпурно-красное, а после стояния—в фиолетовое и, наконец, синее окрашивание. В нормальной моче окрашивание становится желтым.
Проба с салициловым альдегидом. К 10 мл мочи прибавляют 1,0 твердого едкого кали; не дожидаясь его растворения, прибавляют 10 капель салицилового альдегида и нагревают до 70°. В присутствии ацетона появляется пурпурно-красное кольцо, переходящее в карминово-красное и, под конец,—в черное. Без нагревания окраска появляется очень медленно. Эта проба, основанная на конденсации ацетона с салициловым альдегидом, считается безупречной. Доказательством нужно считать только появление тёмнокрасного кольца. Для точного установления ацетона рекомендуется производить не одну, а несколько реакций.
Проба Гергардта на ацетоуксусную кислоту. Моча, подлежащая исследованию, должна быть свежей. К 10 мл подкисленной мочи добавляют 10—15 капель 10%-ного раствора хлорного железа. Образовавшийся осадок отфильтровывают и снова обрабатывают несколькими каплями того же раствора. В присутствии ацетоуксусной кислоты получается бордово-красное окрашивание. Для контроля ставят вторую пробу, нагревая ее при слабокислой реакции до кипения. Если в первой пробе окраска зависела от присутствия ацетоуксусной кислоты, то во второй пробе она должна отсутствовать вследствие разрушения кислоты нагреванием.
Определение индикана в моче. Индикан представляет собой продукт гниения белков и является нормальной составной частью мочи здоровых животных. Особенно много его у лошади.
Индиканом называется эстероподобное соединение индоксила с серной или глюкуроновой кислотой. Исходным продуктом образования индикана является триптофан, который под действием микроорганизмов теряет свою белковую группу и превращается в индол. Последний окисляется в индоксил и связывается с серной или глюкуроновой кислотой. Калийная соль эфиро-серной кислоты индоксила и носит название индикана.
Значительное увеличение индикана в моче может быть кишечного и тканевого происхождения. В первом случае индикан появляется в моче при заболеваниях, связанных с застоем и разложением кишечного содержимого. Во втором случае индиканоурия отмечается при аутолитическом распаде тканей, как это обнаруживается при гангрене легкого, метритах и некоторых других заболеваниях. Качественное изменение индикана в моче основано на гидролизе соединений индоксила и дальнейшем окислении свободного индоксила в синее индиго.
Проба Обермейера. К 10 мл мочи прибавляют 2—3 мл свинцового сахара и после перемешивания фильтруют. Фильтрат мочи в равных частях (5 мл) смешивают с реактивом Обермейера, состоящего из раствора хлорного железа в крепкой соляной кислоте в отношении 0,2 на 100 мл; прибавляют затем 3—5 мл хлороформа и, закрыв пробирку пробкой, осторожно перемешивают жидкость, извлекая образовавшееся индиго. Хлороформ в присутствии индикана окрашивается в синий цвет различной интенсивности, в зависимости от количества индикана в моче. При оценке результатов необходимо учитывать удельный вес мочи. Даже значительное посинение мочи, имеющей удельный вес 1,040, считается нормальным, в то время как даже незначительное посинение мочи с удельным весом 1,010 указывает на увеличе ние индикана.
Проба Жоллеса. К 10 мл мочи добавляют 2 мл 20%-ного раствора свинцового сахара и после встряхивания фильтруют. К фильтрату затем прибавляется 1 мл спиртового раствора тимола или 5% спиртового раствора— нафтола и 10 мл дымящейся соляной кислоты, которая содержит 0,5% хлорного железа. Через 25 минут прибавляют 4 мл хлороформа и встряхивают. Хлороформ окрашивается в синий цвет даже при наличии 10 мг индикана в 10 л мочи.
Определение красящих веществ в моче. Желтый цвет мочи зависит от присутствия в ней нескольких пигментов, из которых наибольшую роль играет урохром. В моче, кроме того, имеется в небольшом количестве гематопорфирин и уробилиноген, переходящий на свету в присутствии воздуха в уробилин. Постоявшая на свету моча травоядных содержит довольно значительное количество уробилина. Особенно его много в моче лошади.
Значительное количество уробилиногена в моче появляется при нарушении функции печени, усиленном разрушении белков в кишечнике, а также при заболеваниях, сопровождающихся значительным разрушением эритроцитов. Уробилиноген образуется из билирубина, который поступает в кишечник с желчью. В кишечнике под влиянием микроорганизмов билирубин переходит в стеркобилин, который, всасываясь в кровь, переходит в уробилиноген. Следовательно, для образования уробилиногена необходимо поступление желчи в кишечник. Большая часть образовавшегося в кишечнике уробилина выделяется с фекалиями и лишь незначительное количество его, всасываясь стенкой, поступает в печень, откуда часть перебрасывается кровью в почки.
Проба Флоренс а. В пробирку наливают 10 мл свежей мочи,, подкисленной 10 каплями серной кислоты. После сильного взбалтывания доливают 5—8 мл эфира. Пробирку после этого закрывают резиновой пробкой и в течение 3—5 минут осторожно переворачивают. Слегка пожелтевший слой эфира отстаивается и наслаивается на концентрированную соляную кислоту. В присутствии уробилина на линии соприкосновения жидкостей получается резко ограниченное розовое или красно-коричневое кольцо. С мочой лошади, постоявшей на воздухе несколько часов, проба Флоренса дает резко положительный результат.
Спектроскопическое определение уробилина. Испытуемая моча должна быть предварительно подкислена несколькими каплями серной кислоты. В присутствии уробилина получается полоса поглощения на границе зеленого цвета с синим. Спектроскопия сильно пигментированной мочи за счет желчных пигментов невозможна.
Определение желчных пигментов. В моче здоровых животных содержатся ничтожные следы желчных пигментов. В увеличенном количестве появляются они в моче при различных формах желтухи. В свежей моче окраска в интенсивно желтый цвет придается билирубином. При стояний такая моча приобретает зеленоватый оттенок вследствие окисления билирубина в биливердин и другие продукты окисления. У собак даже незначительное количество билирубина обнаруживается сравнительно легко. У лошадей обнаружение желчных пигментов в моче служит показателем очень сильной желтухи.. Наиболее значительное количество желчных пигментов отмечается у лошади при инфекционном энцефаломиэлите лошадей. Ценность признаков желтухи и обнаружение желчных пигментов в моче определяется тем, что они выявляются наиболее рано, еще до развития нервных симптомов. По нашим наблюдениям, желчные пигменты в моче появляются у лошади за 1—2 недели, в ряде случаев даже и раньше. Значительное количество желчных пигментов в моче обнаруживается также при отравлении S02, кровепятнистой болезни, крупозной пневмонии и некоторых других заболеваниях.
Проба с дымящейся азотной кислотой (Гмелина). Реакция основана на окислении желтовато-красного билирубина в зеленый биливердин и другие соединения, значение которых для клиники в достаточной степени не доказано. Окислителем при постановке реакции служит дымящаяся азотная кислота.
Берется 5 мл мочи, под которую подслаивается азотная кислота, содержащая следы азотистой кислоты. При наличии билирубина на границе двух жидкостей образуются кольца разных цветов. Образование зеленого кольца на границе кислоты и мочи является показателем положительной реакции на желчные пигменты. Остальные кольца зависят от индикана и других пигментов.
Проба на фильтровальной бумаге по Розен-бергу представляет модификацию пробы Гмелина. Испытуемая моча предварительно фильтруется, после чего на поверхность фильтра, смоченного мочой, наносится 1—2 капли азотной кислоты. В присутствии желчных пигментов вокруг капли кислоты образуется ряд цветных колец. Наружное зеленое кольцо, на месте соприкосновения мочи и кислоты, является характерным для желчных пигментов.
Проба Накаяма. В качестве реактива используется 99 мл 95%-ного спирта, 1 мл крепкой азотной кислоты и 0,4 мл хлорного железа.
К 5 мл мочи добавляют равное количество 10%-ного раствора хлористого бария. Помутневшую мочу центрифугируют. Жидкость сливается, а осадок, состоящий из нерастворимых солей бария, размазывают стеклянной палочкой по дну фарфоровой чашки и осторожно высушивают на легком пламени, затем на неостывшую чашечку опускают одну каплю реактива Накаяма. Для желчных пигментов характерно зеленое расходящееся кольцо. Другие цвета недоказательны.
Проба Синева. Эта проба наиболее проста и удобна для определения желчных пигментов в моче лошади. Мочу, разбавленную пополам водой, обрабатывают равным количеством 20%-ным раствором хлористого бария и после взбалтывания центрифугируют. Прозрачный центрифугат сливается, а осадок растворяется в дымящей азотной кислоте. Для билирубина характерно появление желтого или зеленого окрашивания осадка.
Проба Обермейер а — Проппера. Для определения желчных пигментов необходимо иметь реактив следующего состава: 3,5 мл 10%-ной йодной настойки, 12,0 йодистого калия, 75,0 хлористого натрия, 125 мл 95%-ного спирта и 625 мл дистиллированной воды. Под разведенную дистиллированной; водой мочу подслаивают реактив. В присутствии желчных пигментов появляется синее кольцо, переходящее в зеленое.
Пробы Мухина. 1. К 3—5 мл испытуемой мочи добавляют несколько капель 10%-ного водного раствора уксусной кислоты и затем 0,5— 1 мл скипидара. В течение 1—1,5 минут содержимое пробирки слегка подогревают, постоянно встряхивая, на пламени спиртовой лампочки. Проба считается положительной, если моча окрашивается в зеленый цвет. Чувствительность пробы—1 : 8 000.
2. На 3—5 мл мочи наслаивается 2—3 мл раствора марганцевокислого калия в концентрации 1 : 1 000—1 : 10 000. Моча предварительно фильтруется и должна иметь кислую реакцию. При наличии в моче желчных пигментов на границе соприкосновения жидкостей появляется изумрудно-зеленое кольцо. В зависимости от количества желчных пигментов толщина кольца и интенсивность окрашивания бывают различные. Чувствительность пробы 1 : 4 000— 1 : 8 000. Реакция наиболее характерна для мочи крупного рогатого скота.
Проба Гаммарстена. Для постановки пробы предварительно приготовляют реактив, состоящий из смеси 10 мл 25%-ной соляной "кислоты? и 1 мл азотной кислоты. Эту смесь оставляют стоять при комнатной температуре до тех пор, пока она не станет желтой. Перед постановкой реакции реактив предварительно разбавляют спиртом в 5—10 раз. К 10 мл мочи в центрифужной пробирке добавляют несколько капель хлористого кальция и центрифугируют. Слив жидкость с осадка, добавляют к нему 1—2 мл реактива, который растворяет осадок. Желчные пигменты дают зеленое окрашивание в концентрации 1 : 1 000 000.
Проба Марашаля. К исследуемой моче прибавляют по каплям йодную настойку или люголевский раствор. Положительной реакцией на билирубин будет изменение цвета в зеленый. Розин несколько модифицировал эту реакцию. На исследуемую мочу осторожно наслаивается смесь из одной части настойки иода и девяти частей спирта. На границе жидкостей в присутствии билирубина получается зеленое кольцо.
Проба Гюнтера. К 5 мл ледяной уксусной кислоты прибавляют 0,005 перекиси магнезии и нагревают в пробирке до кипения. Предварительно подщелоченную едким натром мочу приливают к кипящему реактиву. При наличии билирубина тотчас же или после вторичного нагревания жидкость окрашивается в зеленый цвет. При слабой окраске зеленое красящее вещество извлекается при помощи хлороформа.
Проба Гупперта. К исследуемой моче прибавляют углекислый натрий до слабощелочной реакции, после чего добавляют хлористый кальций или барий и производят осаждение до тех пор пока еще образуется окрашенный осадок. Можно с этой целью к моче добавлять также и известковую воду в избытке. Если осадок кипятить в алкоголе, к которому добавлено несколько капель разведенной серной кислоты, то он обесцвечивается, а жидкость окрашивается в присутствии билирубина в зеленый цвет. Эта проба с успехом может быть использована в случаях, когда количество желчных пигментов в моче незначительно. Количество мочи должно быть не меньше 100 мл. Осадок может быть также подвергнут обработке с примесью дымящейся азотной кислоты.
Определение хлоридов в моче. Большая часть хлоридов, поступающих в организм, находится в моче и только незначительная часть—в кале и поту. В моче хлор содержится главным образом в виде хлористого натрия. Содержание хлоридов в моче колеблется у здоровых животных в довольно больших пределах. Эти колебания зависят от содержания хлористого натрия в кормах и воде и от ряда других условий. У здоровой лошади, по Френеру, в течение суток выделяется с мочой 25,0—35,0 хлористого натрия. У собак суточное выделение равно 0,25—5,0. Основным выделителем хлора и зорганизма являются, таким образом, почки. Их выделительная функция настолько велика, что организм в короткое время освобождается от хлористого натрия, поступившего в кровь с кормом.
При голодании и острых лихорадочных заболеваниях количество хлора в моче значительно уменьшается. Падение содержания хлоридов в моче совпадает с нарастанием температуры. С понижением температуры функция почек снова восстанавливается и количество хлоридов в моче резко увеличивается.
Уменьшение выделения хлоридов в моче отмечается также при всех заболеваниях, связанных с развитием воспалительных отеков и скоплением в полостях экссудатов. Напротив, при всасывании транссудатов и экссудатов, после хлороформенного наркоза количество хлоридов в моче резко возрастает.
Одним из лучших способов количественного определения поваренной соли в моче является способ Фольгарда. Этот способ отличается точностью и в то же время легкостью определения конца реакции.
Способ Фольгарда. Раствор хлоридов при кислой реакции осаждается избытком азотнокислого серебра. Остающееся свободным азотнокислое серебро определяется путем обратного титрования раствором роданистого аммония в присутствии сернокислой окиси железа. Кроме избыточного роданистого аммония, получается роданистое железо, окрашивающее раствор в кроваво-красный цвет. Появление окрашивания, не исчезающего при взбалтывании, и служит показателем конца реакции. Ход реакции таков:
AgN03 + N04CNS = AgCNS + NH4N03;
Fe2(S04)8 + 6NH4CNS = 2Fe(CNS)8 + 3(NH4)2S04.
Необходимые реактивы: 1) N/10 раствор азотнокислого серебра (16,994 г на 1 л дистиллированной воды); 2) азотная кислота, свободная от хлора и азотистой кислоты; 3) насыщенный раствор железо-аммиачных квасцов Fe2(S04)3*(NH4)2S04 + 24H20; 4) N/10 раствор роданистого аммония (8,0 роданистого аммония растворяют в 900 мл дистиллированной воды). Для установления титра отмеривают бюреткой 20 мл титрованного раствора азотнокислого серебра, подливают 5 мл раствора железо-аммиачных квасцов, подкисляют азотной кислотой до обесцвечивания и титруют из бюретки раствором родани-
стого аммония до тех пор, пока вся жидкость не даст слабого красноватого окрашивания. На осаждение 20 мл титрованного раствора азотнокислого раствора серебра должно быть израсходовано ровно 20 мл роданистого аммония. Если реакция возникает раньше, раствор роданистого аммония доливают водой до нужной концентрации и проверяют повторным титрованием.
Исследуемая мода должна быть свободна от белка. Мочу, содержащую белок, нагревают до кипения и подкисляют уксусной кислотой до выпадения хлопьев. Совершенно прозрачная жидкость фильтруется в измерительный цилиндр. Количество фильтрата должно быть равно 100 мл. Из этой порции отмеривают 10 мл в измерительную колбу емкостью 100 мл, подливают 3— 4 мл 30%-ной чистой азотной кислоты. Если моча приобретает темное окрашивание, к ней прибавляют 3—4 капли концентрированного раствора марганцево-кислого калия (1 : 30). После многократного взбалтывания окраска переходит в винно-желтую. Затем подливают из бюретки избыточное количество азотнокислого серебра (30 мл), доливают до 100 мл дистиллированной водой, сильно взбалтывают, фильтруют через сухой фильтр; берут из фильтрата пипеткой 50 мл, прибавляют 2—4 мл раствора аммиачно-железных квасцов и титруют избыток азотнокислого серебра раствором роданистого аммония до появления исчезающего при взбалтывании красного окрашивания. При каждом новом прилитии роданистого аммония вновь появляется красное окрашивание. Постепенно серебро вытесняет железо из роданистой соли и окраска исчезает. Это продолжается до тех пор, пока есть свободное азотнокислое серебро, но как только оно перейдет в роданистое серебро, роданистое железо больше не разлагается к окрашивание остается.
Вычисление. Если на 50 мл фильтрата до появления окрашивания израсходовано 6 мл титрованного раствора роданистого аммония, то на весь фильтрат пришлось бы израсходовать 12 мл. Так как 1 мл роданистого аммония соответствует 1 мл титрованного раствора азотнокислого серебра, то из 20 мл прибавленного к моче раствора серебра только 12 мл вступили в реакцию с роданистым аммонием, остальное же количество раствора серебра пошло на связывание хлористого натрия. Определение хлористого натрия производится по формуле:
0,01*8*100/10 = 0,8%
Способ Фольгарда дает хорошие результаты при исследовании мочи лошади. При определении хлоридов в моче собаки, во избежание выпадения веществ, дающих осадок с азотнокислым серебром, Меринг рекомендует следующую предварительную обработку мочи: 20 мл мочи разводят в 60 мл дистиллированной воды, подкисляют, добавляют 5—8,0 свободной от хлора цинковой пыли, 15 мл разведенной серной кислоты (1 : 5) и нагревают в течение 1 часа на водяной бане. Горячую жидкость фильтруют, осадок повторно промывают кипящей водой и, подкислив фильтрат соляной кислотой, определяют в обработанной моче содержание поваренной соли по способу Фольгарда.
Белок и кровь, находящиеся в моче, предварительно должны быть удалены, но этого можно избежать, применяя способ Фольгарда в модификации Рушняка. Для этого мочу разводят водой в 10 раз; 2 мл разведенной мочи отмеривают в колбу емкостью 50 мл, затем вливают 5—7 мл разведенной азотной кислоты, 10 мл 1/100 N раствора азотнокислого серебра и 4—6 капель нормального раствора марганцевокислого калия. Колбу нагревают на небольшом пламени и кипятят жидкость в течение 5 минут. Как только все количество марганцевокислого калия будет израсходовано на окисление, красная окраска исчезает. После этого снова добавляют по каплям раствор марганцевокислого калия и повторяется это до тех пор пока окрашивание перестанет исчезать. По истечении 5 минут кипячение прекращают и еще к горячему раствору прибавляют щепотку глюкозы для восстановления оставшегося в растворе марганцевокислого калия, после чего раствор становится бесцветным. Выделяющееся хлористое серебро сбивается в мелкие хлопья. По охлаждении раствора к нему прибавляют щепотку железно-аммиачных квасцов, после чего производится титрование 1/100 N раствором роданистого аммония до появления розового окрашивания. Все реактивы должны быть свободны от хлора.
Микроскопическое исследование. Микроскопическое исследование мочи имеет самостоятельное значение и служит дополнением к химическому анализу. Оно может дать указание на патологию там, где химический анализ не обнаруживает ничего ненормального. Белка в моче может не быть, а при микроскопии осадка можно выявить заболевание почек. Исследование осадка мочи под микроскопом дает возможность установить не только локализацию процесса, но и выявлять характер заболевания.
При исследовании осадка мочи важно выяснить, выделяется ли он с мочой или появляется в ней после некоторого стояния. Наиболее ценные результаты получаются при исследовании осадка свежей мочи, только что полученной. Необходимо помнить, что некоторые осадки мочи при стоянии могут разрушаться, особенно когда моча собрана в нечистый сосуд. Если моча не может быть исследована сразу после получения, ее следует законсервировать тимолом.
Осадок удобнее всего получать с помощью центрифугирования. Отстаивание мочи там, где нельзя почему-либо произвести центрифугирование ее, производится в больших, емкостью в 200—300 мл, конических стаканах. Особенно удобны для этой цели специальные конические стаканы со стеклянным краном в нижней части, на котором имеется небольшое углубление; в это углубление и собирается осадок. Когда осадок сформируется совершенно, поворотом крана жидкость из стакана выпускается, а кран вынимается и из его углубления извлекается осадок. Моча рогатого скота, собак и кошек дает осадок спустя 2—3 часа, в то время как мочу лошади приходится отстаивать в течение 12—24 часов.
По внешнему виду осадок мочи может быть весьма различным. Различают осадок рыхлый, хлопьевидный, кристаллический или аморфный. По цвету осадок может быть сероватым, белым, красным, темнокоричневым, бурым или зеленым. Окраска осадка зависит от различных красящих веществ мочи-билирубина, кровяных пигментов и крови, а также от органических веществ, поступающих в мочу при патологических процессах.
Для приготовления неокрашенных препаратов берется небольшое количество осадка с помощью пипетки или металлической петли, помещают ее на предметное стекло и, не размазывая, накрывают тонким покровным стеклом. Капля осадка должна быть малых размеров с тем, чтобы она не выступала за пределы покровного стекла и чтобы стекло не смещалось и не плавало на поверхности капли.
Вначале производится ориентировочное исследование, без предварительной обработки осадка. При малом увеличении можно видеть неорганизованные кристаллические осадки. Особенно хорошо они выступают, если с края покровного стекла подпускается капля раствора иода (1,0 иода, 2,0 йодистого калия и 100,0 воды). Для целей окрашивания осадка можно использовать также различные краски в 1%-ном водном растворе. Слизистые вещества рекомендуется окрашивать 1 %-ным раствором ализарин-сульфокислого натрия. В нормальной моче они окрашиваются в красный цвет, при воспалительных процессах в почке и почечной лоханке—в бледножелтый, зернистые цилиндры окрашиваются в желтый цвет, а гиалиновые—в слабофиолетовый.
Тонкие гиалиновые цилиндры хорошо обнаруживаются при окрашивании тушью по Бурри. Окраска производится стерилизованной тушью (1 мл грюблеровской туши стерилизуется с 9 мл воды и разбавляется хлороформом или карболовой кислотой). На предметное стекло наносят каплю туши и в нее вносят небольшое количество осадка и после высушивания микроскопируют обычным способом: организованные осадки мочи—эпителиальные клетки, форменные элементы крови и цилиндры выступают на черном фоне очень четко. Для капель жира можно использовать 1 %-ный раствор осмиевой кислоты, который окрашивает их в черный цвет, или алкогольный раствор судана 3, от которого они окрашиваются в красивый красный цвет.
Для приготовления стойких препаратов, сохраняющихся в течение длительного времени, прибегают к консервированию осадка в желатине. 4,0 желатины растворяют в 12 мл подогретой дистиллированной воды. К горячему еще раствору прибавляют 1 мл глицерина и 0,2 мл концентрированной карболовой кислоты. Тщательно перемешав жидкость, разливают ее тонким слоем в закрытых чашках Петри. Желатина быстро застывает и сохраняется в закрытых чашках до употребления. Для консервирования осадка желатину подогревают на предметном стекле и осторожно перемешивают с каплей осадка мочи. Перемешивая осадок и желатину, следует избегать образования пузырьков воздуха. Приготовленный таким образом препарат осторожно накрывают покровным стеклом, слегка придавливают иглой и исследуют под микроскопом.
Препараты, законсервированные в желатине, сохраняются долго без существенных изменений и могут быть использованы для демонстрации в любое время.
