
- •IX. Общие принципы самоорганизации белков §9.1. Общие принципы и модели самоорганизации глобулярных белков
- •9.1.1. Модель ко-трансляционного сворачивания
- •9.1.2. Модель пост-трансляционного сворачивания
- •9.1.3. Шапероны и шаперонины
- •9.1.4. Общая картина формирования вторичной и третичной структур
- •Вторичная структура
- •Третичная структура
- •§9.2. Образование α-спирали
- •9.2.1. Образование α-спирали (термодинамика)
- •9.2.2. Образование α-спирали (кинетика)
- •§9.3. Образование β-структуры
- •§9.4. Нуклеационный механизм сворачивания
- •§9.5. Денатурация белков
- •9.5.1. Определение
- •9.5.2. Причины, вызывающие денатурацию
- •9.5.3. Характерные особенности денатурации
- •§9.5.4. Расплавленная глобула
- •9.5.5. Механизм денатурации
- •9.5.6. Энергетическая щель в спектре конформационных состояний
- •§9.6. Ренатурация – спонтанная самоорганизация. Полиморфизм
- •9.6.1. Ренатурация
- •9.6.2. Полиморфизм
- •§9.7. Физические основы функциональной организации белков
- •Связывание → трансформация → освобождение.
- •9.7.1. Связывающие белки
- •9.7.2. Трансформирующие белки – ферменты
- •9.7.3. Белки, осуществляющие транспорт
- •9.7.4. Белки, осуществляющие механохимические функции
- •§9.8. Регуляция деления клетки
- •9.8.1. Контроль за делением клеток
- •9.8.2. Апоптоз
- •9.8.3. Естественный предел продолжительности жизни
- •Теломеры
- •Репликационное укорочение хромосом
- •Теломераза. Синтез теломеров
- •Старение
- •О возможности продления жизни
- •Антионкогены и онкогены
- •Фотодинамическая терапия
- •§9.9. Генная инженерия. Моноклональные антитела. Гибридомы
- •§9.10. Мутации и молекулярная эволюция
9.2.2. Образование α-спирали (кинетика)
Рассмотрим процесс образования вторичной структуры в виде α-спирали из гомологичной (состоящей из одинаковых аминокислотных остатков) полипептидной цепи.
Изменение свободной энергии цепи или клубка при образовании α-спирали с фиксацией n аминокислотных остатков описывается формулой (9.1):
,
где свободная энергия инициации спирали
,
свободная энергия элонгации спирали
на один виток
,
![]() – свободная энергия образования
водородной связи в водной среде,
– свободная энергия образования
водородной связи в водной среде,
![]() – изменение энтропии цепи при фиксации
одного остатка в спирали.
– изменение энтропии цепи при фиксации
одного остатка в спирали.
Поскольку вероятность состояния
с энергией F, согласно
распределению Больцмана, пропорциональна
![]() ,
то отношение вероятности спирального
состояния цепи, содержащей n
фиксированных аминокислотных остатков,
и вероятности клубкового состояния той
же цепи равно
,
то отношение вероятности спирального
состояния цепи, содержащей n
фиксированных аминокислотных остатков,
и вероятности клубкового состояния той
же цепи равно
![]() ,
(9.5)
,
(9.5)
где
![]() – фактор инициации (
– фактор инициации (![]() ),
а (9.6)
),
а (9.6)
![]() – фактор элонгации спирали. (9.7)
– фактор элонгации спирали. (9.7)
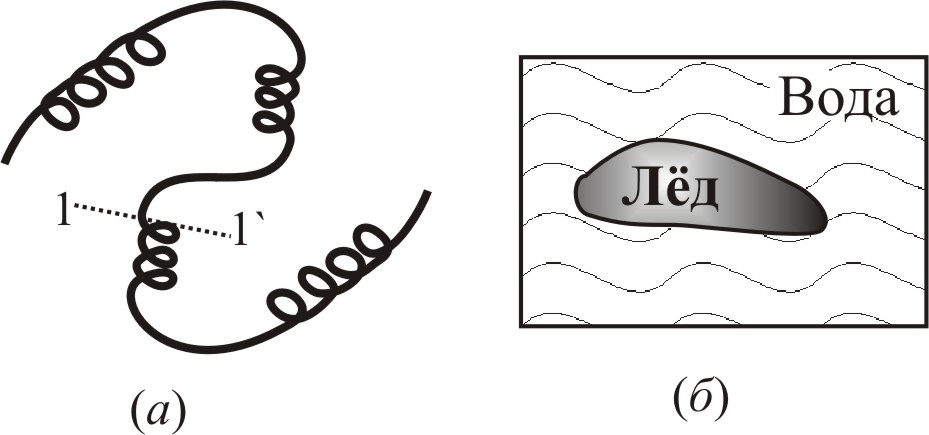
Согласно теореме Ландау в
одномерной системе, какой является
система спираль – клубок (рис. 9–5а)
фазовый переход первого рода невозможен.
Это связано с тем, что в одномерной
системе (а) площадь поверхности
раздела фаз не зависит от размеров обеих
фаз (не зависит ни от длины клубка, ни
от длины спирали). Поэтому фазы не
разделяются, а стремятся сосуществовать,
перемешиваться. В трехмерном случае
(б) площадь поверхности раздела и
связанная с ней энергия зависят от
объема новой фазы (льдинки в воде).
Поэтому, если зародыши новой фазы имеют
размер меньше некоторого критического,
то новая фаза не образуется, если –
больше критического, то новая фаза
оказывается более устойчивой, и при
неизменных параметрах (давлении и
температуре:
![]() ,
,
![]() )
происходит фазовый переход первого
рода (см. т.1, с.176).
)
происходит фазовый переход первого
рода (см. т.1, с.176).
В одномерной системе переход клубок –
спираль имеет конечную ширину
![]() .
В области перехода сосуществуют обе
фазы (спираль и клубок), так как энергия
раздела фаз не зависит от длины
полипептидной части, свернувшейся в
α-цепь.
.
В области перехода сосуществуют обе
фазы (спираль и клубок), так как энергия
раздела фаз не зависит от длины
полипептидной части, свернувшейся в
α-цепь.
Переход совершается при небольшом
значении
![]() .
При этом в α-спираль кооперируется много
звеньев полипептидной цепи, но не вся
цепь целиком (рис.9–6а). Образование
первого витка спирали (зародыша
спиральной структуры) требует
преодоления активационного барьера
высотой finit.
Опыт показывает, что α-спираль образуется
очень быстро: за долю микросекунды
спираль охватывает пептид из 20–30
остатков. Основное время, по-видимому,
тратиться на инициацию зародыша спирали,
а элонгация (нарастание)
спирали происходит со скоростью примерно
один остаток за несколько наносекунд.
.
При этом в α-спираль кооперируется много
звеньев полипептидной цепи, но не вся
цепь целиком (рис.9–6а). Образование
первого витка спирали (зародыша
спиральной структуры) требует
преодоления активационного барьера
высотой finit.
Опыт показывает, что α-спираль образуется
очень быстро: за долю микросекунды
спираль охватывает пептид из 20–30
остатков. Основное время, по-видимому,
тратиться на инициацию зародыша спирали,
а элонгация (нарастание)
спирали происходит со скоростью примерно
один остаток за несколько наносекунд.

(а) (б)
Рис. 9–6. Переход
спираль–клубок при изменении свободной
энергии элонгации fel
при значении фактора инициации
![]() (а).
Такой переход не является фазовым
переходом первого рода, так как по мере
роста длины цепи ширина перехода не
стремится к нулю. Зависимость свободной
энергии спирали
(а).
Такой переход не является фазовым
переходом первого рода, так как по мере
роста длины цепи ширина перехода не
стремится к нулю. Зависимость свободной
энергии спирали
![]() от числа вовлеченных в нее аминокислотных
остатков n0
при разных
значениях свободной энергии элонгации
fel.
(б)
При fel > 0
спираль не образуется, а при fel < 0
спираль стабильна, но для ее образования
требуется энергия инициации finit
, затрачиваемая на преодоление
активационного барьера.
от числа вовлеченных в нее аминокислотных
остатков n0
при разных
значениях свободной энергии элонгации
fel.
(б)
При fel > 0
спираль не образуется, а при fel < 0
спираль стабильна, но для ее образования
требуется энергия инициации finit
, затрачиваемая на преодоление
активационного барьера.
