
- •IX. Общие принципы самоорганизации белков §9.1. Общие принципы и модели самоорганизации глобулярных белков
- •9.1.1. Модель ко-трансляционного сворачивания
- •9.1.2. Модель пост-трансляционного сворачивания
- •9.1.3. Шапероны и шаперонины
- •9.1.4. Общая картина формирования вторичной и третичной структур
- •Вторичная структура
- •Третичная структура
- •§9.2. Образование α-спирали
- •9.2.1. Образование α-спирали (термодинамика)
- •9.2.2. Образование α-спирали (кинетика)
- •§9.3. Образование β-структуры
- •§9.4. Нуклеационный механизм сворачивания
- •§9.5. Денатурация белков
- •9.5.1. Определение
- •9.5.2. Причины, вызывающие денатурацию
- •9.5.3. Характерные особенности денатурации
- •§9.5.4. Расплавленная глобула
- •9.5.5. Механизм денатурации
- •9.5.6. Энергетическая щель в спектре конформационных состояний
- •§9.6. Ренатурация – спонтанная самоорганизация. Полиморфизм
- •9.6.1. Ренатурация
- •9.6.2. Полиморфизм
- •§9.7. Физические основы функциональной организации белков
- •Связывание → трансформация → освобождение.
- •9.7.1. Связывающие белки
- •9.7.2. Трансформирующие белки – ферменты
- •9.7.3. Белки, осуществляющие транспорт
- •9.7.4. Белки, осуществляющие механохимические функции
- •§9.8. Регуляция деления клетки
- •9.8.1. Контроль за делением клеток
- •9.8.2. Апоптоз
- •9.8.3. Естественный предел продолжительности жизни
- •Теломеры
- •Репликационное укорочение хромосом
- •Теломераза. Синтез теломеров
- •Старение
- •О возможности продления жизни
- •Антионкогены и онкогены
- •Фотодинамическая терапия
- •§9.9. Генная инженерия. Моноклональные антитела. Гибридомы
- •§9.10. Мутации и молекулярная эволюция
§9.6. Ренатурация – спонтанная самоорганизация. Полиморфизм
9.6.1. Ренатурация
В разбавленном растворе in vitro глобулярный белок способен к спонтанной самоорганизации (ренатурации), то есть к восстановлению нативной структуры. Если после биосинтеза архитектура белка разрушается температурой или растворителем, не подвергаясь сильной химической модификации (без разрыва цепи), то после нормализации среды структура белка полностью восстанавливается.
Явление спонтанной самоорганизации белков было открыто в 1961 г. на примере спонтанного восстановления биохимической активности и правильных S–S связей в бычьей рибонуклеазе. Хотя за более длительное время, но белок сворачивался в ту же форму, что и in vivo. Это доказывает, что вся информация, необходимая для построения трехмерной структуры белка, содержится в химической последовательности аминокислот в цепи, то есть в первичной структуре белка.
Ренатурация свидетельствует о том, что формирование нативных трехмерных пространственных структур осуществляется не случайным образом, а по воспроизводимой программе, закодированной в последовательности аминокислотных остатков в цепи.
Рис. 9–16.
Сворачивание белка вблизи точки фазового
перехода (а)
и при удалении от точки фазового перехода
в сторону возрастания стабильности
нативной структуры (б)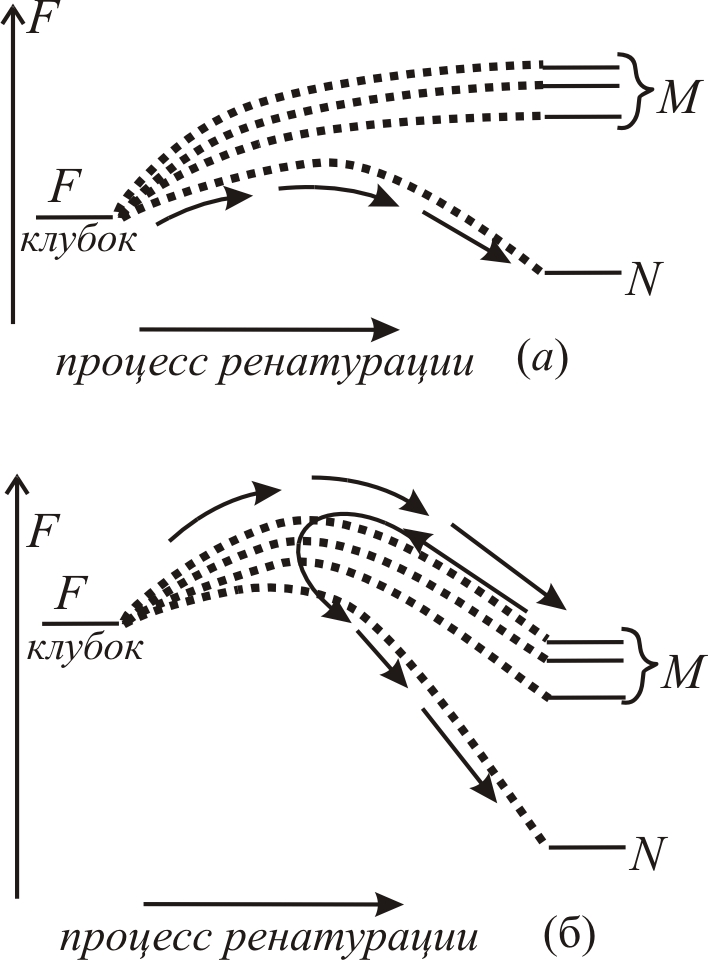
Сворачивание белковой глобулы (переход из состояния клубка со свободной энергией Fклубок в состояние плотной глобулы) вблизи точки фазового перехода, когда стабильной является только одна нативная структура N, а все прочие укладки М (misfolded – ошибочно сложенные) глобулярных структур менее стабильны, показана на рис. 9–16 а. Точечные линии показывают изменение свободной энергии по ходу сворачивания. Неверные структуры М практически не образуются.
При удалении от точки фазового перехода, в сторону возрастания стабильности нативной структуры (понижении температуры или растворении денатуранта водой), многие неверно сложившиеся структуры М могут стать более энергетически выгодными, чем клубковое состояние (рис. 9–16 б). Тогда идет быстрое сворачивание неправильных М структур и их последующее очень медленное частичное разворачивание с переходом в нативную структуру N. Высшие точки пунктирных линий соответствуют свободным энергиям переходных «t» состояний на соответствующих путях сворачивания. Основное направление процесса самоорганизации стабильной пространственной структуры белка показано стрелками. Время сворачивания сильно зависит от условий опыта и, прежде всего, от стабильности нативной N и конкурирующих с ней структур M белка.
Следует заметить, что ковалентные S–S связи между остатками цистеина в белковой цепи способствуют ренатурации белка. В то же время «неправильно» образованные S–S связи лишают белок способности к ренатурации. Например, в яйце при нагревании белки перемешиваются между собой с образованием дополнительных S–S связей, которые при охлаждении не дают белкам вернуться к первоначальному, нативному состоянию.
Рассмотренные процессы ренатурации очень напоминают процесс кристаллизации. При температуре отвердевания можно вырастить (очень медленно) хороший монокристалл. При быстром понижении температуры вместо одного монокристалла образуются отдельные кристаллики.
