- •IX. Общие принципы самоорганизации белков §9.1. Общие принципы и модели самоорганизации глобулярных белков
- •9.1.1. Модель ко-трансляционного сворачивания
- •9.1.2. Модель пост-трансляционного сворачивания
- •9.1.3. Шапероны и шаперонины
- •9.1.4. Общая картина формирования вторичной и третичной структур
- •Вторичная структура
- •Третичная структура
- •§9.2. Образование α-спирали
- •9.2.1. Образование α-спирали (термодинамика)
- •9.2.2. Образование α-спирали (кинетика)
- •§9.3. Образование β-структуры
- •§9.4. Нуклеационный механизм сворачивания
- •§9.5. Денатурация белков
- •9.5.1. Определение
- •9.5.2. Причины, вызывающие денатурацию
- •9.5.3. Характерные особенности денатурации
- •§9.5.4. Расплавленная глобула
- •9.5.5. Механизм денатурации
- •9.5.6. Энергетическая щель в спектре конформационных состояний
- •§9.6. Ренатурация – спонтанная самоорганизация. Полиморфизм
- •9.6.1. Ренатурация
- •9.6.2. Полиморфизм
- •§9.7. Физические основы функциональной организации белков
- •Связывание → трансформация → освобождение.
- •9.7.1. Связывающие белки
- •9.7.2. Трансформирующие белки – ферменты
- •9.7.3. Белки, осуществляющие транспорт
- •9.7.4. Белки, осуществляющие механохимические функции
- •§9.8. Регуляция деления клетки
- •9.8.1. Контроль за делением клеток
- •9.8.2. Апоптоз
- •9.8.3. Естественный предел продолжительности жизни
- •Теломеры
- •Репликационное укорочение хромосом
- •Теломераза. Синтез теломеров
- •Старение
- •О возможности продления жизни
- •Антионкогены и онкогены
- •Фотодинамическая терапия
- •§9.9. Генная инженерия. Моноклональные антитела. Гибридомы
- •§9.10. Мутации и молекулярная эволюция
 л.
IX. Общие принципы
самоорганизации белков
л.
IX. Общие принципы
самоорганизации белков
IX. Общие принципы самоорганизации белков §9.1. Общие принципы и модели самоорганизации глобулярных белков
Процесс самоорганизации структуры белка принципиально отличается от самоорганизации, имеющей место в неравновесных, работающих на притоке энергии системах, так как, во-первых, он относится к процессам возникновения порядка (вторичной и третичной структуры) из порядка (определенной первичной структуры), а не порядка из беспорядка, как в неравновесных системах. Во-вторых, формирование структуры белка – это поиск термодинамически равновесного состояния и не требует наличия неравновесных условий.
В то же время, самоорганизация белка близка к процессу образования кристаллов из жидкой фазы, но, во-первых, не имеющих пространственной периодичности, а во-вторых, очень маленьких размеров.
Пути сворачивания пептидной цепи после ее синтеза на рибосоме определяются генетическим кодом, устанавливающим взаимосвязь между последовательностью аминокислотных остатков в цепи и типом пространственной структуры. Вместе с тем, эффективность образования нативной структуры белка связана с работой высоко координированной системы регуляции, обеспечивающей оптимальные условия для ее формирования внутри клетки. Процесс сворачивания белка проходит несколько стадий (см. с. 710–711).
Нативный белок может иметь одну, в редких случаях – несколько устойчивых конформаций. Нативная конформация очень устойчива, но не является абсолютно жесткой. Образующие ее группы атомов (фрагменты), домены, субъединицы могут в определенных пределах перемещаться в пространстве (сдвигаться и раздвигаться). Вместе с тем следует отметить, что белковая цепь упакована плотно, атом «упирается» в атом. В этом смысле белок тверд. Однако, обычно на рисунках изображается только скелет белковой цепи, отражающий элементы вторичной и третичной структур. Боковые группы удалены, хотя именно они ответственны за физико-химические и геометрические свойства поверхности глобулы. Кроме того, к поверхности белка может прилипать множество молекул воды.
При изменении внешних условий твердый белок ведет себя как апериодический кристалл (по словам Шредингера). Например, при повышении температуры он не теряет своей формы и твердости постепенно, как стекло (см. с. 171–173), а, только достигнув определенного предела, быстро плавится. Это фундаментальное свойство белков тесно связано с надежностью их работы.
Общая пространственная топография белковых глобул определяется тем, что полярные группы расположены, в основном, на поверхности, а неполярные (гидрофобные) – внутри глобулы, образуя её гидрофобное ядро (рис. 9–1).
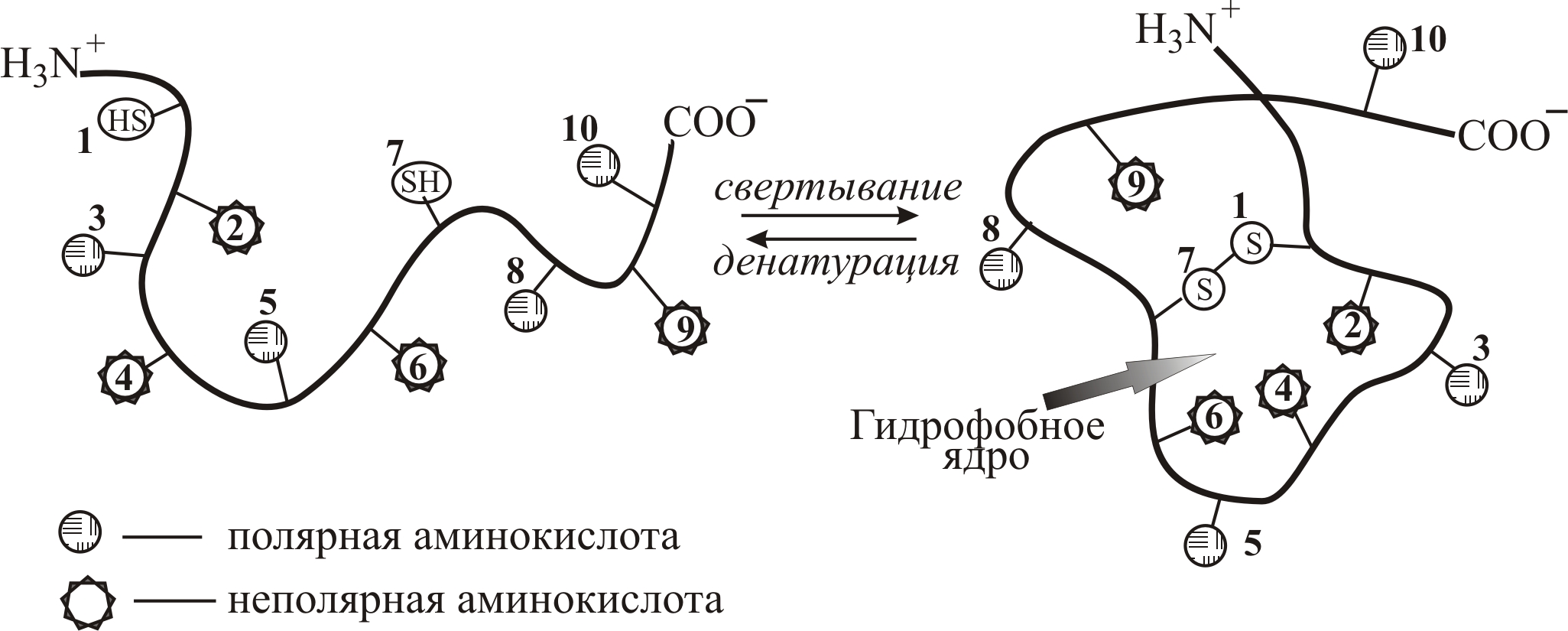
Рис. 9–1. Основные принципы свертывания полипептидной цепи (с образованием гидрофобного ядра) в водной среде
|
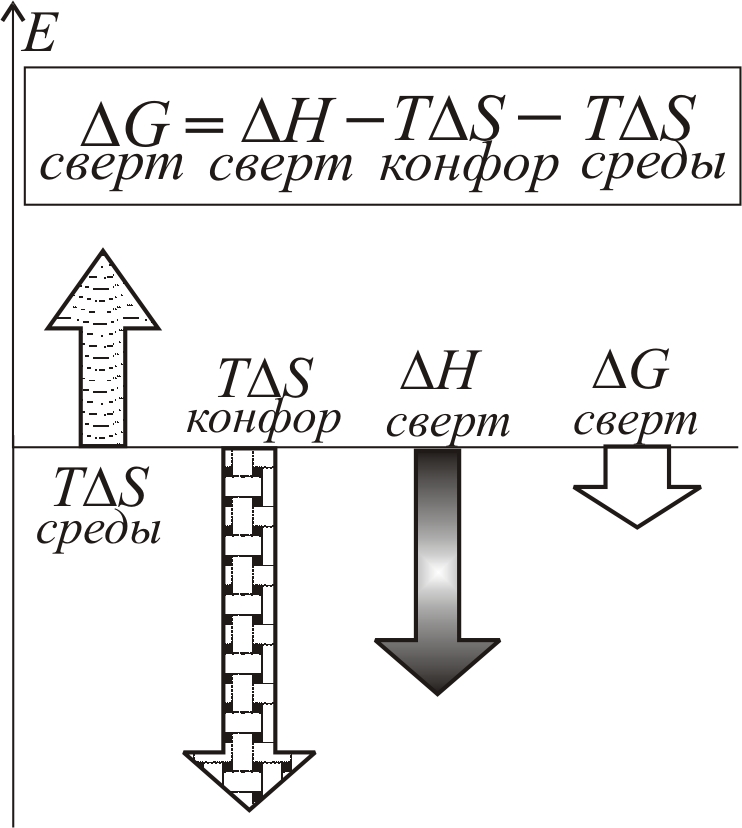
Рис. 9–2.
Энергетические составляющие процесса
сворачивания беловой глобулы:
|
Гидрофобные взаимодействия играют
основную роль (~90%) в синтезе, так
называемой, расплавленной глобулы
(см. с. 711) с гидрофобным ядром.
Стабилизация твердого (глобулярного)
нативного белка происходит под действием
сил Ван-дер-Ваальса, водородных и ионных
– более чувствительных к деталям атомной
структуры, которые после черновой работы
гидрофобных сил формируют окончательную
конфигурацию белковой глобулы. Водородные
связи возникают между боковыми группами
аминокислотных остатков и между NH–
и CО–группами пептидных
цепей, электростатическое притяжение
– между разноименно заряженными боковыми
группами, например COO–
и NH3+. Наиболее
прочными являются ковалентные дисульфидные
связи в цистеиновых мостиках. Все типы
связей, образующиеся в белковой глобуле,
оказывают стабилизирующее действие,
так что энтальпия свертывания отрицательна:
![]() (рис. 9–2).
(рис. 9–2).
Существует две модели сворачивания синтезированной белковой цепи: ко-трансляционная (от лат. со – совместно) и пост-трансляционная (от лат. post – после).