
1. Регуляция на уровне транскрипции
- групповая репрессия генов белками гистонами. Сегмент ДНК, связанный с гистонами не доступен для транскрипции, заблокирован. Гистоны взаимодействуют с достаточно протяженным участком ДНК, поэтому они запрещают транскрипцию сразу с нескольких генов.
- амплификация генов (от англ.: amplification - расширение, увеличение). Термин обозначает увеличение числа копий определенного гена, которое достигается многократным синтезом участка ДНК в одном и том же репликационном пузыре (рис. 14). В результате амплификации, возможна транскрипция одновременно с нескольких копий гена. Как следствие - растет количество соответствующей мРНК и увеличивается синтез данного белка.
Рис. 14

Например, при лечении онкологических больных метотрексатом нередко наблюдается устойчивость к данному препарату. Оказывается, происходит амплификация гена дигидрофолатредуктазы - фермента, который является точкой приложения метотрексата. Поэтому, не смотря на высокую дозировку, препарат теряет эффективность.
- регуляция транскрипции сигналами - усилителями, их роль выполняют энхансерные элементы ДНК (энхансеры, от англ.: to enhance - усиливать). Механизм действия энхансеров остается неясным, однако известны некоторые особенности энхансера.
1. Энхансер значительно удален от промотора.
2. Усиливающий эффект не зависит от ориентации, расположения в ДНК, энхансера.
3. Действие энхансеров неспецифично - усиливают транскрипцию с многих промоторов.
4. Энхансер значительно усиливает транскрипцию (отмечено 200-кратное повышение скорости транскрипции под влиянием энхансера).
5. Энхансер не кодирует синтез какого-либо эффектора
С
13
Сигнальный участок данного белка распознается только на том внутриклеточном элементе, в который белок должен поступить (адресоваться), что во многом определяет специфичный для органеллы набор белков.
Адресование и процессинг белка тесно связаны. Такая взаимосвязь четко прослеживается на примере биосинтеза инсулина. Инсулин - гормон, являющийся низкомолекулярным белком, синтезируется в виде препроинсулина (110АК). Препроинсулин имеет гидрофобный сигнальный участок, который адресует его в эндоплазматический ретикулум. В эндоплазматическом ретикулуме этот сигнальный участок отщепляется и образуется проинсулин. Проинсулин подвергается дальнейшему процессингу: протеазы отщепляют внутренний сегмент одноцепочечной молекулы проинсулина и образуются две цепи (21АК и 30АК), соединенные дисульфидными связями, - это структура функционально зрелого белка инсулина (51 АК), который выделяется в кровь.
Регуляция биосинтеза белка
Известно, что ДНК оплодотворенной яйцеклетки служит источником генетической информации для всех клеток организма. Поэтому, казалось бы и белковый состав всех клеток одного и того же организма должен быть идентичным. Но очевидны отличия в белковом спектре различных клеток: так, гемоглобин свойственен эритроцитам, а коллаген - соединительной ткани. Некоторые клетки имеют специфичные для них ферменты и изоферменты, определяющие особенности метаболизма и функций. Эти и многие другие факты свидетельствуют, что в данной конкретной клетке образуется только часть из совокупности закодированных в ДНК белков. Кроме качественных различий белкового спектра клеток, в зависимости от тех или иных условий, биосинтез белка изменяется и количественно (например, в ходе онтогенеза). Следовательно, биосинтез белка подвержен регуляции.
Регуляция биосинтеза белка у прокариот и эукариот осуществляется неодинаково, что связано с разным уровнем их организации.
Биосинтез белка у прокариот, согласно теории Ф. Жакоба и Ж. Моно (1961 г.), регулируется, в основном, на уровне транскрипции. Благодаря отсутствию в таких клетках ядерной мембраны, первичные транскрипты генов (им соответствуют пре-мРНК эукариот) начинают транслироваться на рибосомах еще до полного завершения процесса транскрипции. Поэтому, у прокариот отсутствует регуляция на этапах процессинга, стабильности и активности мРНК. На уровне трансляции регуляция биосинтеза белка в прокариотических клетках слабо развита и не имеет большого значения. Однако у микроорганизмов найдены белки, способные препятствовать взаимодействию рибосомы с РНК-матрицей, эти белки вызывают репрессию трансляции.
12
Кэп и КСБ обеспечивают присоединение инициирующего комплекса именно к 5`-концу мРНК. При этом, стартовый кодон мРНК несколько удален от присоединившегося комплекса.
Рис. 6
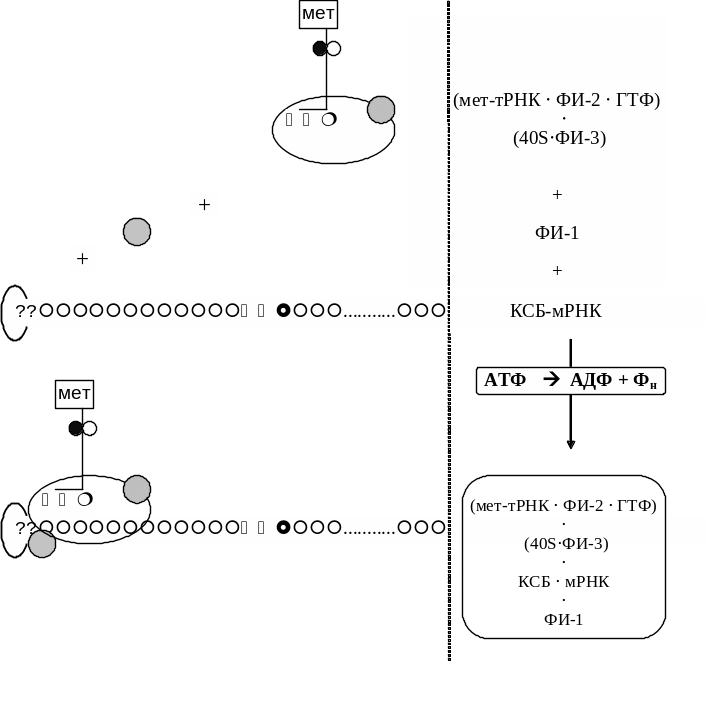

6) Поиск стартового кодона (метионина; АУГ) и комплементарное взаимодействие с ним антикодона инициаторной аа-тРНК (мет-тРНК).
П
5

7) Формирование на мРНК 80S-рибосомы (рис. 8). Большая субъединица рибосомы (60S) присоединяется к малой (40S) только после нахождения кодона АУГ (т.е. после фазы 6). Присоединение 60S рибосомы сопровождается гидролизом ГТФ, находившегося в составе инициирующего комплекса, высвобождением белковых факторов инициации и КСБ.
6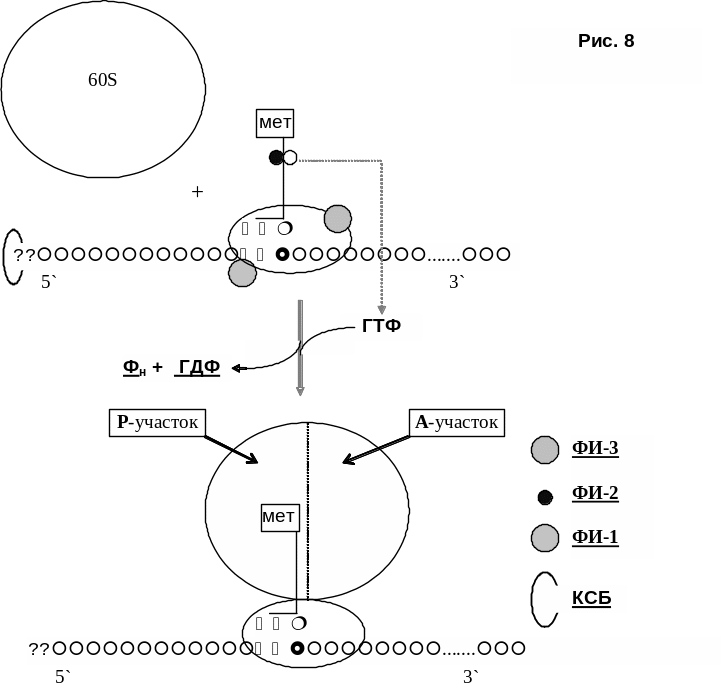
цию в полисоме. Этим сочетанием достигается наиболее значительное повышение выхода полипептидов-копий в расчете на 1 молекулу мРНК.
Процессинг белка. Большинство синтезированных полипептидов являются предшественниками соответствующих белков или пробелками (препробелками), поэтому требуется их созревание - процессинг белка.
Процессинг белка включает совокупность изменений в структуре того или иного полипептида, заканчивающихся формированием структурно и функционально зрелой белковой молекулы.
К наиболее распространенным типам химической модификации полипептидов, относятся:
- ограниченный протеолиз
а) отщепление N-концевой аминокислоты (метионина);
б) отщепление пептидного фрагмента
- ацетилирование
- фосфорилирование
- гликозилирование (присоединение углеводного компонента)
- гидроксилирование (пролина, лизина)
- окисление аминокислот
образование четвертичной структуры
Процессинг может быть котрансляционным (химическая модификация происходит при незаконченном синтезе полипептида, т. е. во время элонгации) и посттрансляционным (процессинг осуществляется после завершения этапа терминации).
Для процессинга конкретного белка характерен определенный тип модификации, или определенный вариант сочетания этих типов. Например, в процессинге коллагена задействованы ограниченный протеолиз, реакции гликозилирования и гидроксилирования, а также - формирование 4-ой структуры.
