
Индутный А. В., Высокогорский В. Е. Молекулярные механизмы трансляции и регуляции биосинтеза белка // Методическое пособие для самостоятельной работы студентов
В методическом пособии, составленном в рамках учебной программы по биохимии, систематизированы имеющиеся сведения о молекулярных механизмах трансляции, адресования и регуляции биосинтеза белка в эукариотических клетках.
.
Э 16 тапы и механизм трансляции
Трансляция (лат.: translatio - передача) - процесс преобразования генетического текста мРНК (иРНК) в последовательность аминокислот полипептидной цепи.
Для процесса трансляции (собственно биосинтеза белка) необходимы:
1. Аминокислоты (20 видов).
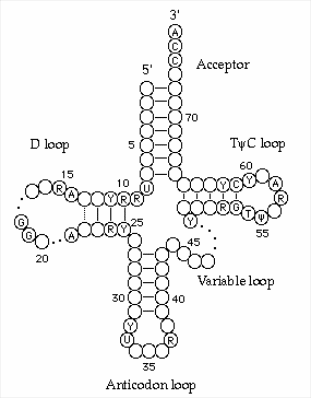
2. тРНК (в цитоплазме эукариот известно 50 видов). Транспортные РНК выполняют функцию адапторов, т. е опосредуют соответствие между последовательностью кодонов мРНК и последовательностью аминокислот в полипептиде. Адапторная функция тРНК обусловлена их строением (рис.1). В тРНК имеются: акцепторный участок , антикодоновая петля, псевдоуридиловая петля, дигидроуридиловая и добавочная петли.
Рис.1

К
1
Считается, что псевдоуридиловая петля участвует в связывании тРНК с рибосомой. Дигидроуридиловая петля - требуется для присоединения к тРНК фермента аминоацил-тРНК-синтетазы. Функция добавочной (вариабельной) петли остается не вполне ясной.
3. Аминоацил-тРНК-синтетазы (20 видов). Данные ферменты обеспечивают связывание аминокислоты с акцепторным участком соответствующей ей тРНК.
4. мРНК. Следует отметить, что мРНК у эукариот, в ходе процессинга приобретает т.н. кэп (от англ.: сap - шапка, кепка).
Кэп присоединен со стороны 5` конца мРНК и представлен метил-ГТФ. Кэп имеет большое значение в процессе связывания эукариотической мРНК с рибосомой.
5. Рибосомы (белково-синтетический аппарат клетки). Рибосомы состоят из двух субъединиц - малой и большой, содержащих рибосомальную РНК (рРНК) и около 80 различных белков. Рибосомы прокариот и эукариот отличаются по размерам. Для эукариот характерны более крупные рибосомы - 80S, состоящие из 40S (малой) и 60S (большой) субъединиц. Для прокариот - 70S, включающие 30S и 50S субъединицы.
6. Энергия фосфатных связей АТФ, ГТФ
7. Mg2+
8. Белковые факторы (кэп-связывающие белки, факторы инициации трансляции, элонгации, высвобождения)
Этапы биосинтеза белка:
РЕКОГНИЦИЯ
 I
Инициация
I
Инициация
ТРАНСЛЯЦИЯ II Элонгация
III Терминация
ПРОЦЕССИНГ БЕЛКА
3 2 . Регуляция на уровне стабильности и активности мРнк
Как уже отмечалось, повторное использование мРНК для трансляции существенно повышает эффективность биосинтеза белка. Следовательно, чем длительнее мРНК будет существовать в цитоплазме, не подвергаясь разрушению ферментами нуклеазами, тем большее количество белка может быть синтезировано на ее основе. На время жизни, на стабильность мРНК, оказывают влияние различные регуляторы, например, гормональные.
У эукариот мРНК может обратимо соединяться с особыми белками цитоплазмы - информатинами. Образуется рибонуклеопротеин, называемый информосомой . мРНК в составе информосомы не доступна для трансляции (неактивна или консервирована). При необходимости, возможна диссоциация информосомы и активация мРНК. Процесс образования и распада информосом, в ряде случаев, контролируется гормонами. Так, известно участие эстрогенов в формировании информосом.
кэп
╠═.....
мРНК
5`
3`
На формирование зрелых белков из препробелков и пробелков оказывают влияние факторы, действующие на совокупность процессов модификации того или иного полипептида. Т. е. имеет место регуляция на этапе процессинга белка. Процессинг белка находится в зависимости от уровня обеспеченности энергией; активности ферментов, осуществляющих модификацию полипептида; концентрации метаболитов, микроэлементов, витаминов, гормонов.
Например, гидроксилирование пролина и лизина в проколлагене необходимо для последующего формирования коллагена. Дефицит аскорбиновой кислоты приводит к снижению интенсивности процесса гидроксилирования и, тем самым, ограничивает синтез коллагена.
Следует отметить, что регуляция на этапе процессинга белка контролирует не количество синтезируемых полипептидов (предшественников белков), а количество соответствующих им зрелых белковых молекул .
м
15
