
- •Методичні вказівки до виконання лабораторних та самостійних робіт з органічної хімії
- •Лабораторна робота № 9 тема: Ароматичні вуглеводні та їх властивості
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №10 Тема: Феноли та нафтоли. Ароматичні спирти.
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №11
- •Контрольні запитання і завдання
- •Лабораторна робота № 12
- •Хід роботи
- •Лабораторна робота № 13
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №14
- •Хід роботи:
- •Лабораторна робота №15
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота № 16
- •Контрольні запитання і завдання
- •Лабораторна робота № 17
- •Хід роботи:
- •Контрольні запитання і завдання
- •Лабораторна робота № 18
- •Хід роботи
- •Контрольні запитання і завдання
Лабораторна робота № 13
ТЕМА: Азо- та діазосполуки.
Основні теоретичні відомості.
Діазосполуки - органічні речовини, в молекулах яких містяться два атоми нітрогену і які відповідають загальній формулі Ar – N2 - X, де Аг - ароматичний радикал, X -кислотний залишок або гідроксил, N2 - атоми нітрогену.

істинних діазосполук:
Азосполуки - органічні речовини, що містять діазогрупу, сполучену з двома радикалами. Найпростіші азосполуки, що відповідають формулі R-N=N-R, можуть бути представлені азометаном H 3 C-N=N-C 6H5 і азобензеном C 6 Н5 – N = N-C6Н5. У радикалах азосполук один або кілька атомів гідрогену можуть бути заміщенні на інші функціональні групи: -ОН, - NH2 , -С ≡ N. Реакцію добування солей діазонію називають реакцією діазотування. Реакції солей діазонію поділяють на дві групи:
1)реакції, які відбуваються з виділенням азоту (діазореакції). До них відносять реакції добування з діазосолей фенолів, галогенпохідних, нітрилів, ароматичних кислот, металоорганічних сполук, вуглеводнів;
2)реакції, що відбуваються без виділення азоту. До них належать реакція утворення азосполук, серед яких є багато азобарвників і кислотно – лужних індикаторів.
34
Хід роботи
ДОСЛІД 1: Діазотування аніліну
Обладнання та реактиви: анілін; 10% розчин хлоридної кислоти; 10% розчин нітриту натрію; йодкрохмальний папірець; пробірки; штативи; кристалізатор; лід; термометр.
У конічній колбі місткістю 50-100мл готують розчин хлориду аніліну: Імл аніліну розчиняють у 10 мл 10% розчину хлоридної кислоти (струшують до повного розчинення солі). Отриманий прозорий розчин гідрохлориду аніліну в розбавленій кислоті охолоджують до 0°С в суміші льоду з холодною водою у кристалізаторі. Не виймаючи колбу з охолодженої суміші поступово, постійно перемішуючи, добавляють 1,5 – 2 мл 10% розчину нітриту натрію. Про закінчення реакції діазотування дізнаються за посинінням йод крохмального папірця. Посиніння цього папірця вказує на появу в суміші вільної нітритної кислоти; в цьому випадку розчин NaNO2 продовжують додавати лише тоді, коли повторна проба (після збовтування суміші) покаже, що нітритна кислота зникла, вступивши у реакцію. Діазотування припиняється, коли в суміші з’являється вільна нітритна кислота, що не зникає при збовтуванні на протязі декількох хвилин. Ця мить звичайно настає після того як майже весь розчин нітриту натрію вже введений в реакційну суміш.
Отриманий майже прозорий розчин солі фенілдіазонію залишають на льоду і використовують для наступних дослідів.
Хімізм:
C6H5 – NH2 + HCl → [ C6H5 – NH3]+Cl-
анілін хлорид аніліну
[ C6H5 – NH3]+Cl- + NaNO2 + HCl → [C6H5 – N ≡ N]+Cl- + NaCl + 2H2O
хлорид аніліну фенілдіазонійхлорид
35
При надлишку нітритної кислоти виділяється вільний йод. Його наявність за посинінням йод крохмального папірця:
NaNO2 + HCl → HNO2 + NaCl
KI + HCl → HI + KCl
2HI + 2HONO2 → I2 + 2H2O + 2NO
I2 + крохмаль → крохмаль * І2
синє забарвлення
Висновки: солі діазонію утворюються в результаті реакції діазотування аніліну. Реакція зводиться до дії нітриту натрію на розчин аміну в кислому середовищі. Виникає сіль, яка зберігається лише за низьких температур (0…+6ºС) – хлорид фінілдіазонію.
ДОСЛІД 2. Добування фенолу з солі фенілдіазонію.
Обладнання та реактиви: сіль діазонію, 2% розчин хлориду феруму (ІІІ), хімічні стакани, пробірки, штативи, водяна баня.
В пробірку наливають 4 – 5 мл розчину солі діазонію, добутої в попередній роботі, поступово нагрівають рідину, підводячи під пробірку стакан з гарячою водою.
Починається виділення бульбашок азоту, далі азот виділяється вже без нагрівання. В пробірці утворюється фенол у вигляді темних крапель. При вдиханні пари відчувається запах фенолу. Для більшої певності в пробірку добавляють кілька крапель 2% розчину хлориду феруму (III). З'являється фіолетове забарвлення як результат утворення комплексних фенолятів феруму (ІІІ), що значною мірою дисоціюють.
Хімізм: При нагріванні сіль фенілдіазонію руйнується з утворенням азоту і фенолу
[C6H5 – N ≡ N]+Cl- + H2O → C6H5 – OH + N2 + HCl
фенілдіазонійхлорид фенол
36
Висновки: солі діазонію реагують з водою вже при кімнатній температурі і ще швидше при нагріванні – діазо група відщеплюється у вигляді молекулярного азоту і заміщується на гідроксил, в результаті фенілдіазоній хлорид утворює фенол.
ДОСЛІД 3: Добування азобарвників
Обладнання та реактиви: диметиланілін; 10% розчин хлоридної кислоти; хлорид фенілдіазонію; насичений розчин ацетату натрію; 10% розчин гідроксиду натрію; β - нафтол (кристалічний); кристалічний фенол; пробірки; штативи; кристалізатор з льодом.
А) Добування анілінового жовтого (диметиламіноазобензолу)
В пробірку вносять 0,5мл диметиланіліну, добавляють 3-5мл дистильованої води і краплями додають 10% розчин хлоридної кислоти до повного розчинення диметиланіліну. Суміш збовтують і охолоджують у льодяній ванні (0.. .+5°С). В охолоджену суміш добавляють 3-4мл розчину хлориду фенілдіазонію, добутого раніше, і потім - насиченого розчину ацетату натрію до випадання жовтого осаду n-диметилазобензолу. Ацетат натрію необхідний для нейтралізації хлоридної кислоти, оскільки реакція азосполучення в кислому середовищі не відбувається.
Хімізм:
СН3

 H+
│
[C6H5
– N
≡ N]+Cl-
+ C6H5
– N(CH3)2
→ − N
≡ N−
─ N
+HCl
H+
│
[C6H5
– N
≡ N]+Cl-
+ C6H5
– N(CH3)2
→ − N
≡ N−
─ N
+HCl
│
Хлористий N,N – диметіл СН3
фенілдіазоній анілін n – диметиламіноазобензол
(аніліновий жовтий)
Нейтралізація хлоридної кислоти відбувається за таким рівнянням реакції:
37
HCl + CH3COONa → CH3COOH + NaCl
Ацетат ацетатна
натрію кислота
Б. Добування судану І
У пробірку вносять 2-Змл 10%-го розчину гідроксиду натрію, добавляють 0,2г β -нафтолу (кристалічного) і 1 - 2мл хлориду фенілдіазонію, добутого раніше. Утворюється осад оранжевого кольору - судан І

фенілдіазоній – хлорид β – нафтол α – фенілазо – β –нафтол
(Судан - І)
В. Добування анілінового оранжевого
В пробірку вносять 2 – 3 мл 10% розчину гідроксиду натрію, добавляють 0,2 г кристалічного фенолу і 1 – 2 мл розчину хлориду фенілдіазонію, добутого раніше. Утворюється осад оранжевого кольору.
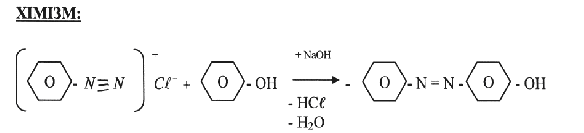
фенілдіазоній хлорид фенол n – оксіазобензол
(аніліновий оранжевий)
ВИСНОВКИ: Взаємодія діазосполуки з ароматичним аміном або
38
фенолом без виділення азоту, яка приводить до утворення атомної групи Аг-N=N-Ar, називається реакцією сполучення діазосполуки. В цій реакції електрофільного заміщення електрофілом є катіон солі діазонія. Продукти реакції сполучення - азосполуки - дуже міцні і яскраво забарвленні. Забарвлення азосполук обумовлене наявністю в молекулі хромофорної групи атомів (азо-групи).
ДОСЛІД 4: Діазотування сульфанілової кислоти.
Обладнання та реактиви: сульфанілова кислота; нітрит натрію; розбавлений розчин лугу; концентрована сульфатна кислота; розчин хлориду феруму (III); пробірки; штативи; хімічні стакани; лід.
Розчиняють 1,5 г сульфанілової кислоти і 0,75 г нітриту натрію в декількох мл розбавленого розчину лугу. Отриманий розчин вливають при помішуванні в стакан з сумішшю 1,5 мл концентрованої сульфатної кислоти і 20 г льоду. Швидко виділяється осад діазобензолсульфокислоти. Через 10 - 15хвилин осад відстоюють. Невелику кількість діазобензолсульфокислоти змішують з 5 – 7 мл води. Отриману суміш ділять на дві частини. Першу частину суміші нагрівають до кипіння. Спостерігається виділення азоту, і осад діазобензолсульфокислоти розчиняється. Після нагрівання, на протязі 5 – 10 хв охолоджують отриманий жовтуватий розчин і добавляють до нього, а також і до другої частини суміші (що не нагрівалась), по декілька крапель розчину хлориду феруму (III). Порівнюють забарвлення розчинів в обох пробірках.
Невикористану діазобензолсульфокислоту, як і всі діазосполуки, відразу ж знищують з великою кількістю води.
ХІМІЗМ
В описаних умовах при підкисленні лужного розчину сульфанілова кислота діазотується нітратною кислотою, що одночасно виділяється, і в осад випадає діазобензолсульфокислота, що має структуру внутрішньої солі:
39


