
- •Методичні вказівки до виконання лабораторних та самостійних робіт з органічної хімії
- •Лабораторна робота № 9 тема: Ароматичні вуглеводні та їх властивості
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №10 Тема: Феноли та нафтоли. Ароматичні спирти.
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №11
- •Контрольні запитання і завдання
- •Лабораторна робота № 12
- •Хід роботи
- •Лабораторна робота № 13
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №14
- •Хід роботи:
- •Лабораторна робота №15
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота № 16
- •Контрольні запитання і завдання
- •Лабораторна робота № 17
- •Хід роботи:
- •Контрольні запитання і завдання
- •Лабораторна робота № 18
- •Хід роботи
- •Контрольні запитання і завдання
Хід роботи
ДОСЛІД 1. Добування аніліну
Обладнання та реактиви: нітробензен, концентрована хлорид на кислота, металічний цинк, розбавлений розчин їдкого натру, лакмусовий папірець, пробірки, штативи.
28
У пробірку вносять кілька крапель нітробензену, додають 0,5 мл концентрованої хлоридної кислоти і кусочок (0,5 г) металічного цинку. Вміст пробірки перемішують і для прискорення реакції злегка підігрівають (доки цинк не розчиниться). Добутий розчин ділять на дві частини. Першу частину залишають для наступного досліду, у другу добавляють 1 – 2 мл води, 1 Н розчину їдкого натру до лужної реакції на лакмусовий папірець і спостерігають за виділенням аніліну.
Хімізм: Реакція утворення аніліну відбувається у кілька етапів. Їх сумарно можна подати таким рівнянням:
Zn + 2HCl → ZnCl2 + 2H
C6H5NO2 + 6H → C6H5NH2 + 2H2O
При надлишку хлоридної кислоти виникає легкорозчинна сіль – анілін хлорид:
С6Н5NO2 + HCl → [ C6H5(NH3)]+ Cl-
Після внесення у суміш їдкого натру виділяється анілін:
[ C6H5(NO3)]+ Cl- + NaOH → C6H5NH2 + NaCl + H2O
Висновки: Відновлення нітробензену проходить через ряд проміжних стадій, а анілін являється кінцевим продуктом цього процесу. Чистий анілін є безбарвною рідиною, що темніє на повітрі, має характерний запах, малорозчинний і воді.
ДОСЛІД 2. Утворення та розкладання солей аніліну.
Обладнання та реактиви: анілін, концентрована хлоридна на кислота, 10% розчин сульфатної кислоти, 10% розчин їдкого натру, пробірки, штативи.
У кожну з двох пробірок наливають по 0,5 мл аніліну, добавляють по 5 – 6 мл дистильованої води і струшують – виникає водна емульсія аніліну. У першу пробірку добавляють кілька крапель концентрованої хлоридної
29
кислоти, у другу – 2-3 мл 10% розчину сульфатної кислоти. Ретельно збовтати. У першій пробірці утворюється легкорозчинна у воді сіль – хлорид аніліну, у другій – осад важкорозчинної солі – сульфату аніліну. У другу пробірку добавляють 3-5 мл 10% розчину їдкого натру. Утворюється емульсія аніліну у водному розчині.
Хімізм: Утворення солей аніліну відбувається за такими хімічними рівняннями:
С6Н5 – NH2 + HCl → [C6H5 – NH3]+Cl-
анілін хлорид аніліну (солянокислий анілін)
С6Н5 – NH2 + H2SO4 → [ C6H5 – NH3]+ HSO4-
анілін гідроген сульфат аніліну
(сірчанокислий анілін)
Після додавання у другу пробірку розчини їдкого натру сіль розкладається:
[ C6H5(NO3)]+ HSO4 + NaOH C6H5NH2 + NaHSO4+ H2O
гідроген сільфат аніліну анілін
Висновки: Анілін, як і усі аміни, має основні властивості . Анілін утворює з мінеральними кислотами стійкі кристалічні солі. Більшість солей аніліну добре розчинні у воді, гірше розчиняється [C6H5NH3]2SO4.
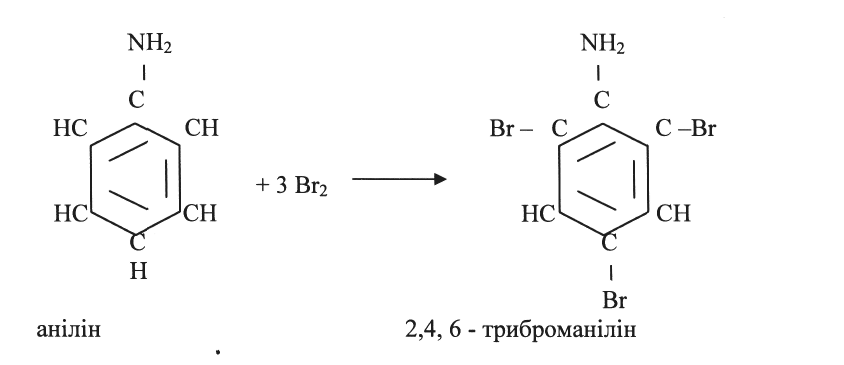
ДОСЛІД 3. Бромування аніліну
Обладнання та реактиви: анілін, бромна вода, пробірки і штативи.
У пробірку вносять 0,5-1 мл аніліну, 5 мл дистильованої води і суміш збовтують. Добавляють такий самий об'єм бромної води. Збовтують. Утворюється оліїста зелено-червона рідина, що перетворюється на твердий осад.
ХІМІЗМ Під час реакції заміщення утворюється 2,4,6, - триброманілін:
30
ДОСЛІД 4. Утворення сульфанілової кислоти.
Обладнання та реактиви: анілін, концентрована сульфатна кислота, пробірки, штативи,
піщаний огрівник.
У пробірку вносять 10-14 крапель аніліну, добавляють, перемішуючи, таку саму кількість крапель концентрованої сульфатної кислоти і вміщують на піщаний огривник, нагрітий до 180-190°С (занурюючи у пісок), на 10-15 хвилин. Після цього пробірку охолоджують до моменту застигання суміші. У пробірку добавляють 5-15 крапель гарячої води і нагрівають до повного розчинення суміші. При охолодженні розчину на дні пробірки з’являється осад сульфанілової кислоти.
ХІМІЗМ Під час нагрівання аніліну з концентрованою сульфатною кислотою (при 180-200 С) утворюється п-сульфокислота - сульфанілова кислота:
31

Висновки: Сульфанілова кислота - кристалічна речовина, важко розчиняється у воді, добре - у органічних розчинниках, плавиться при 228°С. її сульфогрупа, має більш виражені кислотні властивості,ніж неорганічні кислоти. Із сульфанілової кислоти й аналогічних ароматичних аміносульфокислот добувають азобарвники. Сульфанілова кислота - основний структурний компонент сульфамідних препаратів (стрептоциду, норсульфазолу), що проявляють антимікробну дію.
Контрольні запитання і завдання до самостійної роботи
Які речовини називають нітросполуками?
Отримання нітросполук. У яких умовах можна отримати нітрометан; нітробензен; ди- і тринітробензен? Умови реакції нітрування ароматичних сполук.
Які сполуки утворюються при відновленні нітросполук?
Відновлення ароматичних нітросполук – спосіб отримання ароматичних амінів. Умови реакції Зініна.
Здійснити перетворення:
32
піроліз Каt tºC +HNO3 [H2SO4] +3H2, Kat, tºC
2

 CH4
?
? ?
-3H2
-H2O
-2H2O
CH4
?
? ?
-3H2
-H2O
-2H2O
+3H2, Kat, tºC C6H5 – NH2
-2H2O
Написати рівняння реакції:
А) взаємодії аніліну з сульфатною кислотою;
Б) нітрування етанолу та бензолу.
Зобразити графічні формули всіх продуктів нітрування толуолу. Вказати умови проведення реакції.
Які сполуки утворюються при відновленні:
А) нітробензенe;
Б) нітрометану;
В) 1,3 – динітропропану.
Зобразити графічно формули речовин, що утворюються при дії ysnhe.xj]суміші (сульфатна та нітратна кислоти) на анілін.
Здійснити перетворення:
HNO3 [H] CH3COOH
СН3 - СН3 → А → Б → В
33
