
- •Методичні вказівки до виконання лабораторних та самостійних робіт з органічної хімії
- •Лабораторна робота № 9 тема: Ароматичні вуглеводні та їх властивості
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №10 Тема: Феноли та нафтоли. Ароматичні спирти.
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №11
- •Контрольні запитання і завдання
- •Лабораторна робота № 12
- •Хід роботи
- •Лабораторна робота № 13
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №14
- •Хід роботи:
- •Лабораторна робота №15
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота № 16
- •Контрольні запитання і завдання
- •Лабораторна робота № 17
- •Хід роботи:
- •Контрольні запитання і завдання
- •Лабораторна робота № 18
- •Хід роботи
- •Контрольні запитання і завдання
Контрольні запитання і завдання
до самостійної роботи
Які органічні речовини називаються гетероциклічними або гетеро циклами?
У чому виявляється ароматичність гетероциклічних сполук? Наведіть приклади.
Як класифікуються гетероциклічні сполуки? Наведіть структурні формули головних представників окремих груп гетероциклів.
Як добувають тіофен, фуран і пірол за Юр’євим? Накресліть схему.
Напишіть структурні формули відомих вам п’ятичленних гетероциклів з одним і двома гетероатомами.
Напишіть структурні формули відомих вам гетероциклів з шестичленним ядром, з одним і двома гетероатомами. Яке значення цих сполук?
Чим зумовлені основні властивості піролу і піридину? Наведіть рівняння відповідних хімічних реакцій.
Напишіть структурні формули і назви головних гетероциклів з конденсованими ядрами.
Які гетероциклічні сполуки відносять до групи індолу? Напишіть структурні формули їх головних представників.
Що таке пурин і пуримідин? Пуринові і пуримідинові основи. Напишіть їх структурні формули.
60
Лабораторна робота № 16
Тема: Синтетичні полімери і поліконденсати.
Основні теоретичні відомості
Полімери – високомолекулярні сполуки , що характеризуються молекулярною масою від декількох тисяч до багатьох мільйонів. Молекули полімерів (макромолекули) складаються з великої кількості ланок, що повторюються.
Полімери отримують методами полімеризації або поліконденсації.
Полімеризація – це реакція утворення полімерів шляхом послідовного приєднання молекул низькомолекулярної речовини (мономера).Полімеризація являється ланцюговою реакцією. В залежності від характеру активних часток розрізняють радикальну та іонну полімеризації. При радикальній полімеризації процес ініціюється вільними радикалами. Реакція проходить через декілька стадій: а) ініціювання; б) ріст ланцюга; в) передача або обрив ланцюга.
Іонна полімеризація проходить через стадію утворення активних центрів, росту та обриву ланцюга.
Радикальна полімеризація являється промисловим способом синтезу:
Полівінілхлориду [ - CH2 – CHCl - ]n;
Полівінілацетату [ - CH2 – CH(OCOCH3) - ]n;
Полістиролу [ - CH2 – CH(C6H5) - ]n;
Поліакрилату [ - CH2 – C(CH3(СООR)) - ]n;
Поліетилену [ - CH2 – CH2 - ]n;
Полідієну [ - CH2 – C(R) = СН – СН2 - ]n;
Метод іонної полімеризації використовується у виробництві
Поліізобутилену [ - CH2 – C(CH3)2 - ]n;
Поліформальдегіду [ - CH2О - ]n;
Полі-ε- капроаміду (капрону) [ - NH – (CH2 )5 - CO - ]n;
61
Бутадієнового каучуку [ - CH2 – CН = СН – СН2 - ]n;
Реакція синтезу полімерів з сполук, що мають дві або більше функціональні групи, яка супроводжується утворенням низькомолекулярних продуктів (Н2О; NH3;HCl; CH2O), називаються поліконденсацією.
Методом поліконденсації отримують: полікапромід (капрон), полігексаметиленадипінамід (найлон) [ - NH(CH2)6NHCO(CH2)4CO - ]n; поліуретани [ - OROCONHR’NHCO - ]n; полісилоксани [ - SiR2 – O - ]n; поліацеталі [ - OROCHR’ - ]n.
Макромолекули полімерів можуть бути лінійними, розгалуженими, сітчастими. Лінійні полімери утворюються при полімеризації мономерів або при лінійній поліконденсації. Розгалужені полімери можуть утворюватися і при полімеризації, і при поліконденсації. Сітчасті полімери утворюються в результаті зшивки ланцюгів при полімеризації.
Лінійні макромолекули можуть мати регулярну та не регулярну структуру. У полімерах з регулярною структурною окремі ланки ланцюга повторюються у визначеній послідовності та розташовуються в просторі у визначеному порядку.
Полімери, у яких окремі ланки розташовані у просторі безсистемно, мають не регулярну структуру.
Полімерам властиві реакції: сполучення макромолекул поперечними зв’язками; взаємодії функціональних груп один з одним та низькомолекулярними речовинами; деструкції. Наявність у макромолекул подвійних зв’язків та функціональних груп обумовлює підвищення реакційної здатності полімерів.
Хід роботи:
ДОСЛІД 1. Добування фенол формальдегідних смол конденсацією фенолу з формальдегідом.
Обладнання та реактиви: фенол, формалін, концентрована хлорид на кислота, концентрований розчин аміаку, спирт, розбавлений розчин лугу,
62
пробірки, штативи, кип’ятильні камінці, годинникове скло, фільтрувальний папір.
А. Поміщають у пробірку 2,5 г фенолу, 5 мл формаліну, вносять кип’ятильний камінець, нагрівають суміш до утворення однорідної рідини і обережно кип’ятять її 1 – 2 хв. Потім приливають з іншої пробірки 0,2 – 0,3 мл концентрованої хлоридної кислоти. При збовтуванні гаряча суміш починає кипіти без підігрівання; через 1 – 2 хв рідина стає каламутною і відшаровується важке, непрозоре масло, що поступово густіє. Зливають верхній водний шар і добавляють у пробірку такий об’єм води. Знову кип’ятять суміш 1 – 2 хв., зливають воду, а смолу з залишком води виливають на годинникове скло. Отримують світло – бузкову пластичну смолу, її знімають зі скла, висушують фільтрувальним папером і зжимають у грудку. При зберіганні вона поступово твердіє і робиться крихкою – тим швидше чим довше тривало кип’ятіння.
Б. Повторюють дослід А, але замість хлоридної кислоти вводять до слегка застиглої суміші фенолу і формаліну 1,5 мл концентрованого розчину аміаку. В цих умовах отримують прозору смолу, але вона утворюється дещо повільніше і в меншій кількості, ніж у досліді А, її колір коричнево – жовтий.
При недостатній тривалості нагрівання смола в дослідах А і Б виходить липкою і майже не затвердіває.
Випробовують розчинність невеликої кількості отриманих смол у спирті і в розбавленому розчині лугу при нагріванні.
В. Частину отриманої у досліді А або Б смоли обережно нагрівають у сухій пробірці, тримаючи пробірку горизонтально. При цьому видаляється надлишок води, а головна частина смоли плавиться. При припиненні нагрівання розплавлена смола затвердіває у вигляді прозорої щільної маси, а при продовженні нагрівання смола розпухає і знову затвердіває, але у вигляді пористої маси. При подальшому нагріванні ця маса обвуглюється.
Після охолодження пробірки, випробовують розчинність отриманого продукту у спирті в розчинні лугу при кипінні.

64
Внаслідок такої ступінчастої взаємодії добувають новолачну смолу, в структурі якої виділяють елементарну ланку, що регулярно повторюється.

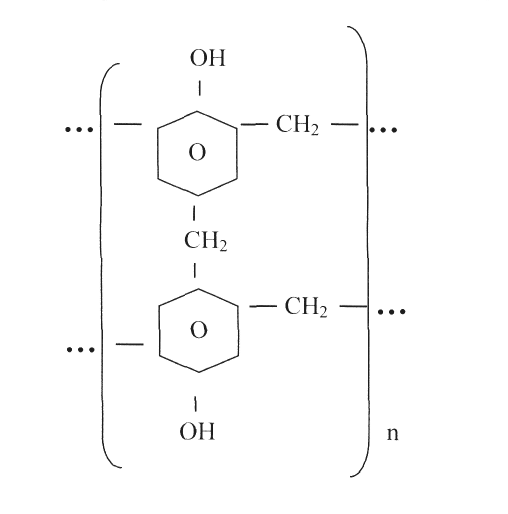
ВИСНОВКИ: Фенол швидко взаємодіє з формальдегідом в розчині лише в присутності каталізаторів (кислот або лугів), і хід процесу - електрофільного заміщення орто- і пара- атомів гідрогену — в значній мірі визначається характером каталізатора.
65
В присутності кислот конденсація однієї молекули формальдегіду з двома молекулами фенолу з відщепленням води дає n,n´- діоксидифенілметан, котрий з надлишком тих же речовин утворює новолачну смолу; в ній містяться макромолекули різної будови. Такі смоли легко плавляться і розчиняються в органічних розчинниках.
При взаємодії фенолу з формальдегідом в присутності лугів першими продуктами реакції являються переважно ізомерні оксибензилові спирти, які конденсуються з відщепленням води та утворенням резолів. Таким чином новолачна смола з надлишком формальдегідом може утворювати резол, а останній дією надлишку фенолу можна перетворити у новолочну смолу. Резоли легко плавляться і добре розчинні в органічних розчинниках. При нагріванні до 150 - 160ºС резоли переходять у резити в результаті «зшивання», тобто утворення поперечних містків між окремими лінійними макромолекулами. Резити не плавляться і не розчиняються. В умовах досліду А формальдегід беруть у надлишку, тому з новолачної смоли при нагріванні може утворювати резол і резит. Розчинність цих продуктів вказує на наявність лінійних не надто великих макромолекул, а розчинність в розчинах лугів – на наявність вільних фенольних гідроксильних груп.
«Зшивання» молекул з утворенням резитів різко прискорюється в присутності лужних каталізаторів. У досліді Б аміак спочатку зв’язується формальдегідом. По мірі зв’язання формальдегіду фенолом аміак вивільняється і стає лужним каталізатором. Якщо каталізатором являється гідрооксид натрію – продукти реакції довго залишаються в розчині і виділяються лише при довготривалому кип’ятінні.
ДОСЛІД 2. Добування гліфталевої смоли.
Обладнання та реактиви: фталевий ангідрид або фталева кислота, гліцерин, спирт (або ацетон), пробірки, штативи, кип’ятильні камінці, піпетки, скляні пластинки.
66
У пробірку поміщають 2 г фталевого ангідриду, 0,5 – 1 мл гліцерину (піпеткою) і вносять кип’ятильний камінець. Нагрівають, підтримуючи кипіння суміші 6 – 10 хв. Рідина у пробірці поступово густішає і жовтіє. Пара, що виділяється має запах акролеїну.
У ході нагрівання через 2 – 3 хв беруть скляною паличкою пробу вмісту пробірки (по 1 – 2 краплі) і поміщають на скляну пластинку; після закінчення кип’ятіння виливають ще гарячу густу рідину з пробірки на пластину, де вона і затвердіває. Порівнюють консистенцію та липкість проміжних проб і головної маси смоли.
У пробірку з залишками смоли наливають 2 – 3 мл спирту або ацетону і випробують розчинність смоли при кімнатній температурі і при кип’ятінні.
Дослід можна проводити, замінивши фталевий ангідрид фталевою кислотою.
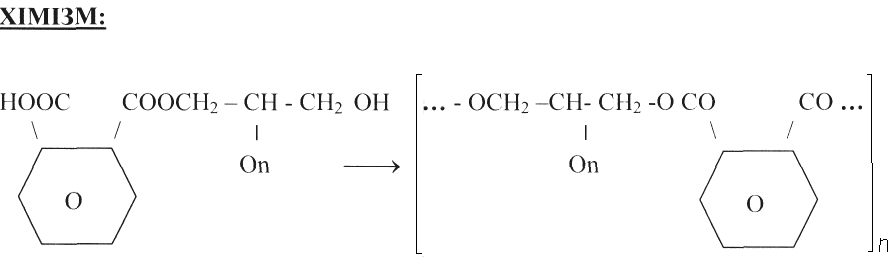
Висновки: При взаємодії фталевої кислоти з багатоатомними спиртами утворюються кислі ефіри, які потім можуть конденсуватися у довгі лінійні макромолекули. У цих реакціях ангідрид реагує швидше, ніж кислота.
При нагріванні з гліцерином фталева кислота спочатку утворює лінійний поліефір, що представляє собою м’яку смолу, розчинну у спирті.
При подальшому нагріванні (вище 160ºС) лінійні макромолекули
67
поступово зв’язуються між собою («зшиваються») за рахунок вільних –ОН груп залишків гліцерину і карбоксильних груп взятих у надлишку фталевої кислоти –СООН груп кислих ланцюгових поліефірів, що вже утворилися. При цьому відщеплюється вода і утворюються нові, вже поперечні ефірні зв’язки. У результаті утворюється тривимірна жорстка сітчаста структура макромолекул, і отриманий продукт – гліфталева або алкідна смола – вже не пом’якшуються при нагріванні. Гліфталеві смоли відносно крихкі і малорозчинні. Чим довше кип’ятіння реакційної суміші, тим більш крихка та малорозчинна отримується смола.
