
- •Методичні вказівки до виконання лабораторних та самостійних робіт з органічної хімії
- •Лабораторна робота № 9 тема: Ароматичні вуглеводні та їх властивості
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №10 Тема: Феноли та нафтоли. Ароматичні спирти.
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №11
- •Контрольні запитання і завдання
- •Лабораторна робота № 12
- •Хід роботи
- •Лабораторна робота № 13
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №14
- •Хід роботи:
- •Лабораторна робота №15
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота № 16
- •Контрольні запитання і завдання
- •Лабораторна робота № 17
- •Хід роботи:
- •Контрольні запитання і завдання
- •Лабораторна робота № 18
- •Хід роботи
- •Контрольні запитання і завдання
Лабораторна робота №15
Тема: Гетероциклічні сполуки
Основні теоретичні відомості:
Гетероциклічні сполуки – органічні речовини, молекули яких побудовані з циклів, утворених крім атомів карбону атомами інших хімічних елементів, найчастіше – нітрогену, сульфуру, оксигену. Останні називають гетеро атомами, циклічні системи – гетеро циклами. Гетероциклічні сполуки класифікують за розміром циклів молекул (три-, чотири-, п’яти-, шестичленні), за кількістю кілець (моно-, бі-, три-, і багатоциклічні), за природою гетероатома (містять нітроген, сульфур, оксиген), за взаєморозташуванням циклів (вільні гетероцикли і гетероцикли з конденсованими ядрами), за кількістю гетероатомів у циклі (один, два і більше). Більшість гетероциклічних сполук мають тривіальні назви, вони і є основою назв їх похідних. Для позначення місця розміщення замісника атоми гетероциклічного кільця нумеруються, починаючи нумерацію від гетероатома літерами грецького алфавіту – α, β, γ – (при раціональних назвах) або цифрами (за номенклатурою ІЮПАК).
До гетероциклічних сполук належать такі біологічно важливі речовини, як хлорофіл рослин і гемін крові, пуринові і піримідинові основи нуклеїнових кислот, гетероциклічні амінокислоти (триптофан і гістидин) та амінокислоти (пролін і оксипролін), вітаміни (В1, В2, В3, В4, В5, В6), коферменти (НАД, ФАТ), гормони (вазопресин, окситоцин, мелатонін), алкалоїди, антибіотики, медикаменти (анальгін), барвники (індиго, акрихін).
Хід роботи
ДОСЛІД 1. Утворення фурфуролу з пентозанів.
Обладнання та реактиви: природний матеріал, що містить пентозани (тирса, скорлупа арахісу, макуха), хлоридна кислота концентрована, розчин хлориду феруму (ІІІ), водяна баня, газовідвідна трубка, пробірки, штативи.
Біля 1 г вихідного матеріалу змішують у пробірці з 2 – З мл хлоридної
50
кислоти, 4-5 мл води та декількома краплями розчину FеС13. Суміш нагрівають 15хв на водяній бані, далі приєднують газовідвідну трубку у іншу пробірку 1 -2мл рідини. Відгін має запах фурфуролу.
ХІМІЗМ:
І стадія. Кислотний гідроліз пентозанів
(С5Н8О4)n + n H2O → nC5H10O5
пентозами пентози
ІІ стадія. Дегідратація пентоз і утворення фурфуролу.

пентоза
ВИСНОВКИ; у лабораторних умовах фурфурол можна отримати шляхом кислотного гідролізу пентозанів, що містяться в природній сировині.
ДОСЛІД 2: Реакції фурфуролу
Обладнання та реактиви: фурфурол; оксид аргентуму (аміачний розчин); фуксинсульфітна кислота; фенілгідразин гідрохлорид; ацетат натрію; анілін; флороглюцин; льодяна оцтова кислота; фільтрувальний папір; НС1; пробірки; штативи.
водним розчином фурфуролу проводять слідуючи реакції:
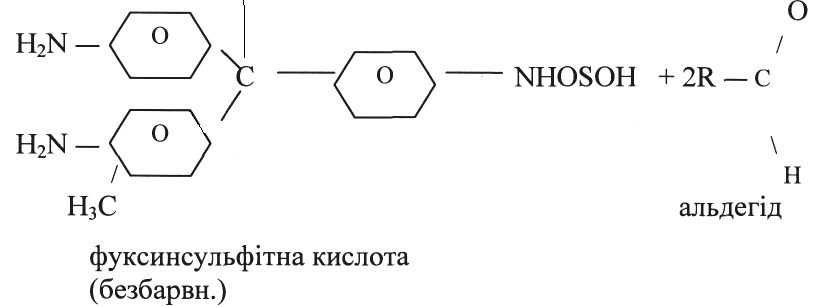
А) Реакція з фуксинсульфітною кислотою
У пробірку наливають 1 мл розчину фуксинсульфітної кислоти і
51
додають декілька крапель фурфуролу. Відмічають забарвлення розчину. Додають 0,5 мл НСІ (конц) і знову відмічають зміну забарвлення - відразу і через 5-10хв.
Хімізм:
SO2OH

(червоне з відтінком синього забарвлення)
ВИСНОВКИ: Реакція з фуксинсульфітною кислотою дуже чутлива і характерна для альдегідів. Розчин фуксинсульфітної кислоти безбарвний, але при приєднанні альдегідів до кислоти розчин
52
забарвлюється в червоний колір з відтінком синього. Ці сполуки поступово реагують з надлишком сульфітного ангідриду, відбувається відщеплення альдегіду з поступовим утворенням вільної фуксинсульфітної кислоти; тому при стоянні розчин поступово знебарвлюється.
При додаванні мінеральних кислот у надлишку забарвленні продукти приєднання альдегідів до фуксинсульфітної кислоти знебарвлюється.
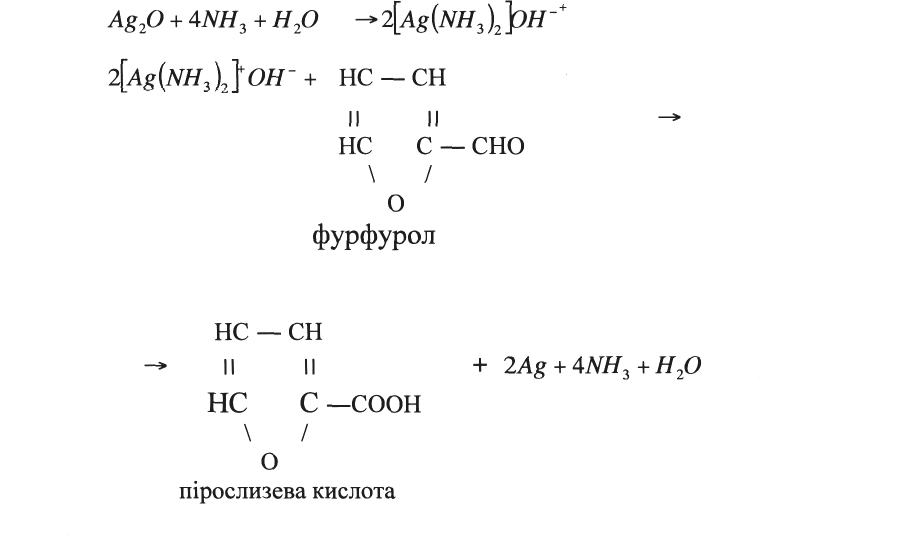
Хімізм:
53
Висновки: Альдегіди, окислюючись, відновлюють сполуки аргентуму у лужному середовищі до металічного срібла. Ця якісна реакція на альдегіди була розроблена Толленсом у 1881 році.
В). Реакція з фенілгідразином
Розчиняють в 3 – 4 мл води декілька кристалів (0,1 – 0,2 г) гідро хлориду фенілгідразину і приблизно в 1,5 рази більшу кількість ацетату натрію. До розчину додають декілька крапель фурфуролу. При струшуванні з розчину виділяється кристали фенілгідразону.

Висновки: Утворення фенілгідразонів, що добре кристалізуються і мають характерні температури плавлення, часто використовуються для ідентифікації альдегідів.
Г )
На годинниковому склі змішують по
декілька крапель аніліну та льодяної
оцтової кислоти. Отриманою рідиною
змочують шматок фільтрувального наперу,
віджимають, поміщають на нього краплю
розчину фурфуролу. Утворюється яскраве
рожево – червоне п’ятно.
)
На годинниковому склі змішують по
декілька крапель аніліну та льодяної
оцтової кислоти. Отриманою рідиною
змочують шматок фільтрувального наперу,
віджимають, поміщають на нього краплю
розчину фурфуролу. Утворюється яскраве
рожево – червоне п’ятно.
Хімізм:
НС − СН
║ ║
Н
 С
С ─СНО + 2С6Н5
−NH2→
С6Н5NН
− СН ═ СН ═ С(ОН) −СН═NС6Н5
С
С ─СНО + 2С6Н5
−NH2→
С6Н5NН
− СН ═ СН ═ С(ОН) −СН═NС6Н5
О
фурфурол анілін оксиамін
54
Висновки: Фурфурол стійкий у кислому середовищі та летючий з водяною парою; тому кольорова реакція з аніліном у відгоні дозволяє відкрити утворення саме фурфуролу. Кольорова реакція фурфуролу з аніліном обумовлена утворенням продукту конденсації. Внаслідок наявності спряжених подвійних зв’язків цей продукт яскраво забарвлений.
Д) До 1 – 2 мл розчину фурфуролу вносять 3 – 5 крапель хлоридної кислоти і декілька кристалів флороглюцина. При нагріванні суміш забарвлюється у темно – зелений колір, при наступному розбавленні водою випадає темний осад.
Хімізм:
С6Н4О2 + С6Н3(ОН)3 → С11Н6О3
-2Н2О
фурфурол флороглюцин
Висновки: Забарвлений продукт конденсації малорозчинний у воді, це використовується в одному з методів кількісного (вагомого) визначення фурфуролу.
ДОСЛІД 3. Реакція хіноліну.
Обладнання та реактиви: хінолін, пікринова кислота (насичений водний розчин), танін (10% водний розчин), НgCl2 (3 – 5 % водний розчин), HCl (конц.), розчин лугу, лакмусовий папір, розчин FeCl3, розчин KMnO4, пробірки, штативи.
Струшують 1 мл хіноліну з 5 – 6 мл води; відмічають характерний запах хіноліну. Дають відстоятися важким краплям хіноліну, зливають водний розчин в іншу пробірку і використовують для дослідів.
До хіноліну, що залишився, додають 1-2мл води, а потім по краплям
55
концентровану хлоридну кислоту до повного розчинення хіноліну. До рідини, що, розігрілася, додають розчин лугу; виділяють краплі вільного хіноліну.
З водним розчином хіноліну проводять наступні досліди:
А. поміщають краплю розчину хіноліну на червоний лакмусовий папір. Потім приливають 0,5 мл розчину хіноліну до 1 мл розчину хлориду феруму (III). Спостерігають виділення гідрату оксиду феруму.
Хімізм:
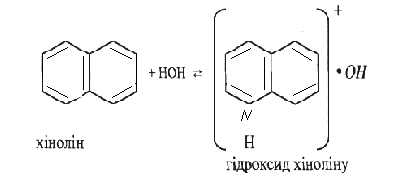
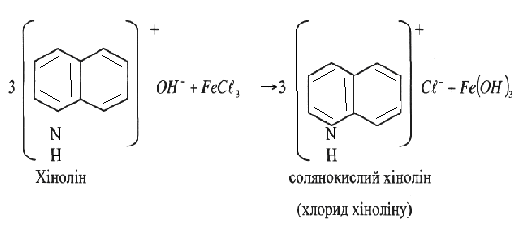
Висновки: Лужні властивості хіноліну проявляються слабко.
Б. змішують рівні об'єми (по 0,5- 1 мл) розчинів хіноліну, перманганату калію та соди. При нагріванні спостерігають знебарвлення розчину та виділення осаду діоксоманганату (IV).
Хімізм:
56

Висновки: Хінолін легко окислюється перманганатом калію, при цьому окисненню піддається бензольне кільце конденсованої біциклічної молекули хіноліну. В результаті утворюється двоосновна хінолінова кислота.
В. До 2 -3 мл розчину пікринової кислоти додають 0,3 – 0,5 мл розчину хіноліну. Відразу ж утворюється осад пікрату хіноліну.
Хімізм:
С6Н7N + C6H2(NO2)3OH → C9H7N ∙ C6H2(NO2)3OH
хінолін пікринова кислота пікрат хіноліну
Висновки: Пікринова кислота з гетероциклами утворює молекулярні комплекси, що добре кристалізуються. Утворення пікратів використовується при кількісному аналізі.
Г. Змішують 2 – 3 мл розчину таніну і 0,5 – 1 мл розчину хіноліну. Виділяється білий осад.
Д. До 0,5 – 1 мл розчину хіноліну приливають 0,5 – 1 мл розчину HgCl2 (ОБЕРЕЖНО ОТРУТА!); утворюється білий осад. Потім додають 2 – 3 мл води і 0,5 мл концентрованої хлоридної кислоти.
Хімізм:
С6H7N + HgCl2 → C9H7N ∙ HgCl2
Висновки: Як і багато інших амінів, хінолін утворює сполуки з танілом та солями важких металів.
57
ДОСЛІД 4. Індиго як барвник.
Обладнання та реактиви: індиго (порошок); хлорид стануму (ІІ) (10 – 12% водний розчин з додаванням хлоридної кислоти до зникнення помутніння); Na2S 2O4 ∙ 2H2O дитіонітом натрію (порошок); смужка білої тканини.
А. До 5 – 6 мл розчину хлориду стануму (ІІ) додають по каплям розбавлений розчин лугу до розчинення осаду. Окремо розтирають у ступці 10 – 20 мг індиго з 1 – 2 мл води. Краплю отриманої суспензії індиго вводять у приготовлений розчин станіту і поміщають пробірку у водяну баню, що кипить. Темно – синя не прозора реакційна суміш швидко стає зеленою, а потім світло – жовтою і зовсім прозорою.
Продовжуючи нагрівання, додають у пробірку суспензію індиго порціями по 2 – 3 краплини, кожен раз досягаючи зникнення синього забарвлення при нагріванні. Утворюється темно-жовта прозора рідина, іноді з невеликим осадом і з тонкою синьою плівкою на поверхні.
При роботі з дитіонітом натрію поміщають у пробірку 0,1 - 0,2 г порошку і 1-2 мл води, потім вносять одразу всю суспензію індиго і 1 - 2 мл розчину лугу. При струшуванні та обережному нагріванні осад зникає і утворюється темно-жовтий розчин.
Б. Біля 1 мл отриманого в досліді А розчину переносять в іншу пробірку, додають 2 – З мл води, закривають пробірку пробкою і струшують. Жовта рідина швидко синіє, стає непрозорою і з неї виділяється осад індиго.
В. В жовтий лужний розчин барвника, що залишився, занурюють смужку білої тканини змоченої водою і віджатої. Залишають на 1 - 2 хв, потім виймають, віджимають і висушують на повітрі. Тканина швидко зеленіє, а через декілька хвилин забарвлюється в інтенсивний синій колір. Випробують, чи змивається барвник водою.
Хімізм: Розчин станітів лужних металів являються сильними відновниками:
58
SnO22- + H2O → SnO32- + 2H
Іноді використовують дитіонітом натрію Na2S2O4 ∙ 2H2O, який також являється сильним відновником:
Na2S2O4 + 2NaOH → 2Na2SO3 + 2H
При відновленні в лужному середовищі індиго перетворюється у біле індиго (лейкоіндиго), що має фенольний характер і розчиняється у розчинах лугів з утворенням жовтих розчинів; кисень повітря швидко окислює цей продукт в індиго.
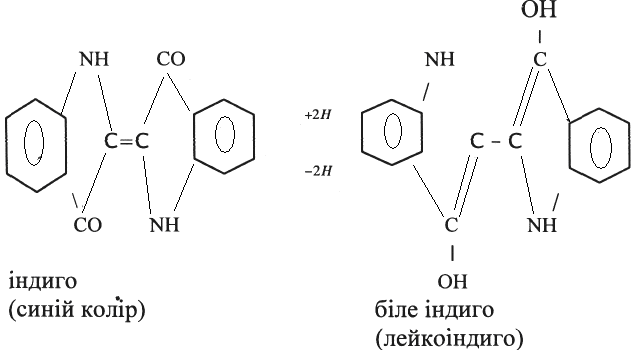
ВИСНОВКИ: Лужний розчин лейкоіндиго, так званий куб, легко просочує тканину. При послідуючій дії повітря адсорбована тканиною лейкосполука переходить в нерозчинний барвник; виділяючись в товщі волокон, індиго міцно зв'язується з ними.
59
