
- •Методичні вказівки до виконання лабораторних та самостійних робіт з органічної хімії
- •Лабораторна робота № 1
- •Основні теоретичні відомості
- •Хід роботи
- •Лабораторна робота № 2
- •Хід роботи
- •Лабораторна робота № 3
- •Хід роботи
- •Лабораторна робота № 4
- •Хід роботи
- •Лабораторна робота № 5
- •Хід роботи
- •Лабораторна робота № 6
- •Хід роботи
- •Лабораторна робота № 7
- •Хід роботи
- •Лабораторна робота № 8
- •Хід роботи
- •Контрольні запитання і завдання до самостійної роботи
Лабораторна робота № 4
ТЕМА: Альдегіди та кетони
Основні теоретичні відомості
Альдегіди
і кетони (оксосполуки) - похідні вуглеводів,
у молекулах
яких
один або кілька атомів гідрогену заміщені
на карбонільну групу
![]() = О.
= О.
В альдегідів одна з валентностей атома карбону такої групи сполучена з гідрогеном, друга - з радикалом.
У молекулі
кетону обидві валентності карбонільної
групи сполучені з радикалами
![]()
Альдегіди і кетони розглядають як продукти окислення спиртів.
Альдегіди є продуктом окислення первинних спиртів, а кетони - вторинних.
Альдегіди і кетони поділяють на ациклічні (насичені й ненасичені) та циклічні.
Для альдегідів і кетонів характерна ізомерія радикалів (структурна ізомерія) . Для кетонів, крім того, існує вид ізомерії - метамерія ( формулі С5H10O відповідає два метамери пентанон-3 і пентанон-2, і ще один ізомер, існування якого зумовлене ізомерією вуглеводного радикалу-З-метилбутанон-2).
Альдегіди і кетони добувають окисленням спиртів, дегідруванням спиртів, омиленням дигалогенозаміщених вуглеводів, гідратацією алкінів за реакцією М.Г.Кучерова, сухою перегонкою кальцієвих солей карбонових кислот, омиленням естерів, методом Гріньяра.
Оксосполуки хімічно активні, їх активність зумовлена наявністю у молекулі карбонільної групи, де атоми карбону і оксигену перебувають у стані sp2 -гібридизації, що здійснюється одним σ- і одним π-зв'язками. Такий зв'язок поляризований. Атом оксигену карбонільної групи має підвищену електронегативність, а електрони π-зв'язку зміщені до атома оксигену. Це приводить до збільшення електронної густини на атомі оксигену карбонільної групи, і він набуває негативного заряду (δ-). Атом карбону - позитивного (δ+):
\
![]() =
=![]()
/
Це спричинює зміщення електронів, розміщених поряд карбон-карбонових зв'язків:
R1-![]() →
→
→
→![]() ←
-R2
←
-R2
Атом карбону карбонільної групи має знижену електронну густину і вступає в реакцію з нуклеофільними агентами . Атом оксигену, маючи підвишену електронну густину, є нуклеофільним. Зміщення електронної густини до атома оксигену спричиняє приєднання молекул до карбонільної групи.
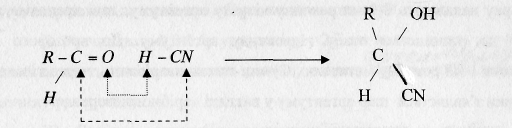
альдегід ціанідна гідроксинітрил
кислота
Альдегіди хімічно більш активні, ніж кетони. Для альдегідів і кетонів характерні реакції приєднання, заміщення, окислення і конденсації.
Кетони не можуть відновлювати аміачні розчини аргентуму і купруму. Не реагують з фуксинсульфатною кислотою (якісна реакція на альдегіди). Вони не вступають у реакцію альдольної конденсації, важче окислюються.
Хід роботи
ДОСЛІД 1. Реакція відновлення альдегідами гідроксиду купруму (II).
Обладнання та реактиви: пробірки, пальник 10% розчин їдкого натру, 10% розчин формаліну, розчин сульфату купруму.
У пробірку наливають 2-3 мл 10% розчину NaOH і доливають 1 мл 10% розчину формаліну. Додають кілька крапель розчину сульфату купруму - випадає блакитний осад гідроксиду купруму (II). Нагрівають верхню частину суміші, з'являється оксид купруму (І) червоного кольору. Метаналь утворює на стінці пробірки «мідне дзеркало».
ХІМІЗМ
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
блакитний осад
HCOH + 2 Cu(OH)2 → HCOOH + Cu2O + 2 H2O
метаналь мурашина червоний
кислота осад
HCOH + 2CuO → HCOOH + 2 Cu
ВИСНОВОК: Блакитний осад гідроксиду купруму (II) взаємодіє з метаналем з утворенням мурашиної кислоти та червоного осаду купруму (І), може взаємодіяти з новими порціями метаналю, що зумовлено відкладанням на стінках пробірки тонкого шару металічної міді.
ДОСЛІД 2. Відновлення альдегідами сполук срібла (реакція «срібного дзеркала»).
Обладнання та реактиви: пробірки, штативи, 1-2% розчин нітрату аргентуму, 5% розчин аміаку, 11% розчин метаналю.
У пробірку наливають 2-3 мл розчину нітрату аргентуму, далі краплями додають розчин аміаку до розчинення осаду гідроксиду аргентуму. До прозорого розчину краплями додають 1 мл розчину метаналю. Суміш злегка нагрівають, через кілька хвилин на стінці пробірки з'являється шар аргентуму у вигляді «срібного дзеркала».
ХІМІЗМ.
AgNO3 + NH4OH →AgOH + NH4NO3
2AgOH → Ag2O + H2O
Ag2O + 4NH4OH → 2[Ag(NH3)2]+OH- + 3H2O
HCOH + 2[Ag(NH3)2]+OH- → HCOOH + 2Ag + 4NH3↑ + H2O
ВИСНОВОК: Реакцію «срібного дзеркала» використовують у хімічному аналізі для виявлення альдегідів, а також для виготовлення та відновлення дзеркал.
ДОСЛІД 3. Добування уротропіну.
Обладнання та реактиви: форфорові чашки, щипці, водяний огрівник, 10% розчин формаліну, 25% розчин аміаку.
У фарфорову чашку вносять 2-3 мл розчину формаліну, додають 4-5 мл розчину аміаку і випарюють на водяному нагрівнику.
ХІМІЗМ.
О
//
6H – C + 4NH3 → (CH2)6N4 + 6H2O
\ утропин
H (гексаметилентетрамін,
гексамін)
ВИСНОВОК: У результаті взаємодії розчину формаліну з аміаком, після випарювання, утворюється кристалічний осад уротропіну.
ДОСЛІД 4. Реакції уротропіну.
Обладнання та реактиви: пробірки, штативи, хімічні стакани, пальник, уротропін (крист.), сульфатна кислота (розб.),розчин лугу (конц.), розчин нітрату аргентуму.
I. До 0,2-0,5г уротропіну добавляють 1мл. сульфатної кислоти, суміш нагрівають до кипіння. З'являється запах формальдегіду. Суміш охолоджують і додають 1 мл розчину лугу, нагрівають до кипіння і обережно нюхають пари.
II. Розчиняють 0,2-0,5г уротропіну у 2-3 мл води і ділять розчин на дві частини. До однієї додають декілька крапель розчину нітрату аргентуму, потім доливають другу частину розчину уротропіну.
III. Декілька кристалів уротропіну нагрівають у пробірці і встановлюють, чи утворюються у результаті його розкладу газоподібні продукти з характерним запахом.
ХІМІЗМ.
6CH2O + 4NH3 → C6H12N4 + 6H2O
уротропін
ВИСНОВКИ: Реакція утворення уротропіну оборотна але її рівновага здвинута праворуч. При нагріванні уротропіну з кислотами аміак зв'язується, а формальдегід виходить з реакції; при нагріванні з лугами виділяється аміак. В обох випадках рівновага здвигається ліворуч, відбувається гідроліз уротропіну.
Уротропін з нітратом аргентуму дає білий осад комплексної сполуки C6H12N4∙AgNO3, що розчиняється у надлишку уротропіну.
При нагріванні сухого уротропіну він возгоряється без розкладання, відщеплюється лише трохи аміаку.
Уротропін у вигляді таблеток використовується як тверде паливо.
ДОСЛІД 5. Отримання оксиму ацетону.
Обладнання та реактиви: пробірки, штативи, хімічні стакани, гідроксиламін гідрохлорид, лійка, фільтрувальний папір, ацетон, карбонат натрія (безводні у порошку), льодяна вода, холодний спирт.
У широку пробірку наливають 7 мл води і розчиняють 2 г солянокислого гідроксиламіану і 1,5г безводної соди. Розчин охолоджують у льодяній воді. Додають 1,5мл ацетону. З розчину випадають білі кристалики оксиму ацетону
ХІМІЗМ.
2 NH2OH + HCl + Na2CO3 → 2NH2OH + 2NaCl + CO2 + H2O
(CH3)2C = O + H2NOH → (CH3)2C = NO + H2O
ВИСНОВКИ: При реакції альдегідів і кетонів з гідроксиламіном утворюються оксим і вода. Отримання оксимів використовують для ідентифікації альдегідів і кетонів.
КОНТРОЛЬНІ ЗАПИТАННЯ І ЗАВДАННЯ
до самостійної роботи
Які речовини називають альдегідами?
Які речовини називають кетонами?
Які речовини утворюються при окисленні первинних і вторинних спиртів?
Як отримати ацетальдегід із ацетилену?
Напишіть структурні формули:
а) пропаналь;
б) 3-метилбутаналь;
в) диізопропілкетон;
г) 3-метилпентаналь;
д) гептанон-2.
6. Напишіть рівняння реакції взаємодії бутаналю з:
а) ціанідною кислотою; б) аміаком; в) етанолом;
г) гідроксиламіном і назвіть продукти реакцій.
7. Здійсніть перетворення:
C2H6
![]()
8. Які сполуки утворюються при гідратації у присутності солей Нg2+ сполук:
a) CH ≡ CH;
б) CH ≡ C – CH3;
в) H3C – C ≡ C – CH3
9. За яких умов можна здійснити перетворення:
CH3 – CHCl – CH3 ?→ CH3 – CH = СH2 ?→
?→CH3C ≡ CH ?→ CH3 – C – CH3
||
O
10. Назвати за міжнародною номенклатурою наступні речовини:
О
//
а) CH3 – CH – CH2 – C ;
| \
CH3 H
О
//
б) CH3 – CH – CH – CH2 – C ;
| | \
CH3 C2H5 H
О
//
в) CH3 – CH – CH2 – C .
| \
C4H9 H
